Questões Sobre Termologia - Física - concurso
2081) Se um refrigerador “consome”, por ciclo, um trabalho de 100J, entregando 250J para o ambiente exterior, então a energia retirada do ambiente interno (onde se guarda os alimentos etc.), por ciclo, através de calor é de:
- A) 150J.
- B) 200J.
- C) 300J.
- D) 400J.
- E) 500J.
A alternativa correta é letra A) 150J.
Gabarito: LETRA A.
Podemos resolver esse problema usando a Primeira Lei da Termodinâmica, que é uma forma de expressar a conservação de energia em um sistema termodinâmico. Matematicamente, essa lei pode ser escrita da seguinte maneira:
Delta U = Q - W
Onde:
- Delta U é a variação da energia interna (positivo, se a temperatura do sistema aumentar, e negativo, se a temperatura do sistema diminuir)
- Q é o calor (positivo, se o sistema absorver calor do meio externo; negativo, se o sistema ceder calor ao meio externo)
- W é o trabalho (positivo, se o sistema se expandir, realizando trabalho sobre o meio externo; negativo, se o sistema se contrair, recebendo trabalho do meio externo)
Entretanto, a variação da energia interna no ciclo de um refrigerador ideal é nula. Isso ocorre porque o refrigerador retorna ao seu estado inicial após cada ciclo de operação. Assim, temos:
Q - W = 0
Q = W
No entanto, o calor adicionado ao sistema é composto pelo calor absorvido (retirado, ou seja, positivo) do ambiente interno e o calor cedido (entregue, ou seja, negativo) para o ambiente externo. Assim, podemos escrever:
Q_{abosrvido} + Q_{cedido} = W
Q_{abosrvido} = W - Q_{cedido}
De acordo com o enunciado, o sistema cede 250J para o ambiente externo. Assim, vamos substituí-lo com sinal negativo, pois a energia está sendo retirada do ambiente interno, o que é o objetivo de um refrigerador para manter o ambiente interno frio. Além disso, se o refrigerador "consome", por ciclo, um trabalho de 100J, significa que o trabalho está sendo realizado sobre ele. Ou seja, o trabalho também será substituído com sinal negativo. Então, podemos escrever:
Q_{absorvido} = -100 - left(-250 right)
Q_{absorvido} = -100 +250
Q_{absorvido} = 150 , J
Portanto, a resposta correta é a alternativa (a).
2082) Se a temperatura de um corpo variou de 10ºC então esta variação, expressa na escala Kelvin, é:
- A) 283K.
- B) 300K.
- C) 200K.
- D) 100K.
- E) 10K.
A alternativa correta é letra E) 10K.
Gabarito: LETRA E.
Para encontrar uma relação entre duas escalas, é preciso conhecer pelo menos 2 pontos em comum entre elas. Sabemos que a fusão do gelo ocorre em 0°C, o que equivale a 273 K, e a vaporização da água ocorre em 100°C, correspondente a 373°F. Assim, podemos estabelecer uma relação entre as duas escalas como nos mostra a figura a seguir:
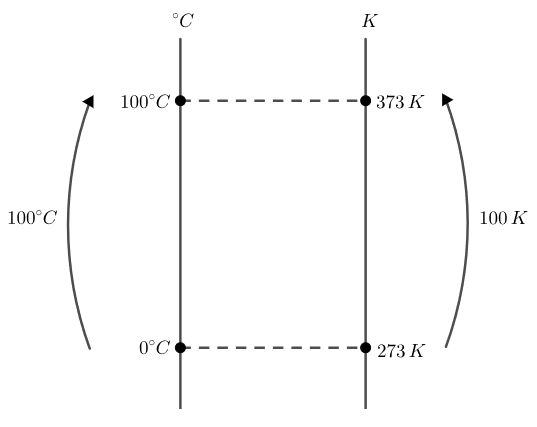
Assim, utilizando a relação de proporção entre as escalas, podemos verificar que a relação entre a variação de temperatura em graus Celsius (Δ°C) e a variação de temperatura em Kelvin (ΔK) é de 1:1. Isso significa que a variação de temperatura em graus Celsius é igual à variação de temperatura em Kelvin.
Então, se a temperatura de um corpo variou de 10ºC, então esta variação, expressa na escala Kelvin, é de 10 K.
Portanto, a resposta correta é a alternativa (e).
2083) De acordo com a lei de Stefan-Boltzmann a intensidade I da luz irradiada por um corpo é proporcional a quarta potência da temperatura absoluta T de modo que I = eσT4; aqui e é a emissividade do corpo e σ é a constante de Stefan. Assim, se a temperatura do corpo aumentar de T para 3T então a intensidade da luz irradiada passa de I para
- A) 3I
- B) 4I
- C) 80I
- D) 81I
- E) 82I
A alternativa correta é letra D) 81I
Gabarito: LETRA D.
Como o enunciado menciona, a intensidade da luz irradiada é dada por:
I = e sigma T^4 tag 1
Assim, se a temperatura do corpo aumentar de T para 3T então a intensidade da luz irradiada será dada por:
I' = e sigma left(3Tright)^4
I' = e sigma left(3^4T^4right)
I' = e sigma left(81T^4right)
I' = 81e sigma T^4
Substituindo a equação (1), temos:
I' = 81I
Portanto, a resposta correta é a alternativa (d).
2084) O calor latente de fusão é característico para cada substância. À pressão normal, representa a quantidade de calorias necessárias para que 1 g de uma dada substância passe do estado sólido para o líquido. A tabela a seguir representa o calor latente e a temperatura de fusão de algumas substâncias à pressão normal.
- A) P e Q.
- B) Q e X.
- C) X e Z.
- D) Z e R.
- E) R e Y.
A alternativa correta é letra B) Q e X.
Gabarito: LETRA B.
Quando a temperatura de fusão de uma substância é maior do que a temperatura ambiente, a substância estará no estado sólido à temperatura ambiente. Por outro lado, se a temperatura de fusão for menor do que a temperatura ambiente, a substância estará no estado líquido à temperatura ambiente. Assim, para determinar quais substâncias estão no estado sólido à temperatura ambiente de 25°C, podemos verificar quais substâncias têm uma temperatura de fusão acima de 25 ºC.
Observando a tabela do enunciado, podemos verificar que apenas as substâncias Q e X têm temperatura de fusão acima de 25ºC (1083°C e 327°C, respectivamente). Logo, apenas essas duas substâncias estão no estado sólido à temperatura ambiente (25 ºC).
Portanto, a resposta correta é a alternativa (b) Q e X.
2085) Em região com clima desértico; normalmente existe grande amplitude térmica. Tendo em vista que a temperatura máxima ao longo do dia foi de38 “C e que, à noite, a mínima foi de menos 4 ºC, a máxima variação de temperatura do dia para a noite foi de
- A) - 42ºC.
- B) +38ºC.
- C) 4 ºC.
- D) +42 ºC.
- E) -38 ºC.
A alternativa correta é letra A) - 42ºC.
Pessoal, questão fácil mas que podemos errar no sinal.
Quando falamos em variação ("delta"), temos temperatura final - temperatura inicial.
Logo,
Delta T = -4 - (+38) = - 42 ,o C
Reparem que precisamos colocar a temperatura da noite primeiro, depois a do dia. Se invertêssemos, colocaríamos erroneamente o gabarito na LETRA D.
Gabarito: LETRA A.
2086) A Primeira Lei da Termodinâmica estabelece que a variação da energia interna (ΔU) de um sistema é dada pela diferença entre o calor trocado com o ambiente (Q) e o trabalho realizado no processo termodinâmico (W), da seguinte forma: ΔU = Q – W. Assim, quando o trabalho realizado pelo sistema for igual ao calor fornecido a ele, haverá uma transformação
- A) adiabática.
- B) isovolumétrica.
- C) isobárica.
- D) isotérmica.
- E) com diminuição de temperatura.
A alternativa correta é letra D) isotérmica.
Pessoal, a questão forneceu a relação de energia interna.
A depender do seu concurso/prova, é bom ter a relação em mente, pois a grande maioria dos processos seletivos não fornece.
Delta U = Q - W
Delta U = 0
Reparem que como o calor é igual ao trabalho, temos que a variação da energia interna é nula.
A variação de energia interna tem relação direta com a temperatura, pessoal. Quanto maior a temperatura, maior a energia interna. Logo, concluímos que a D é o nosso gabarito.
a) adiabática.
ERRADA. Ocorre quando não há transferência de calor (Q = 0).
b) isovolumétrica.
ERRADA. Ocorre quando não há variação de volume (W = 0).
c) isobárica.
ERRADA. Ocorre há pressão constante.
d) isotérmica.
CORRETA: Conforme explicado.
e) com diminuição de temperatura.
ERRADA. Vai em contradição com o explicado.
Gabarito: LETRA D.
2087) Uma garrafa de capacidade térmica desprezível contém 900g de água à temperatura ambiente de 30ºC.
- A) 2.
- B) 3.
- C) 4.
- D) 5.
- E) 6.
A alternativa correta é letra C) 4.
Gabarito: LETRA C.
De acordo com a lei da conservação da energia, a soma do calor cedido pela água à medida que ela esfria deve ser igual com o calor absorvido pelos cubos de gelo, durante a fusão enquanto sólido e o aquecimento de 0°C até 10°C enquanto líquido, deve ser zero:
Q_{água} + Q_{gelo} = 0 tag 1
A quantidade de calor que é responsável pela mudança de temperatura é calculada utilizando a equação do calor sensível:
Q = mc Delta T tag 2
Onde m é a massa, c é o calor específico e Delta T é variação de temperatura. Já o calor responsável pela mudança de estado (fusão) é calculado a partir da equação do calor latente:
Q = mL tag 3
Onde m é a massa e L é o calor de fusão. Assim, substituindo as equações (2) e (3) na equação (1), podemos escrever:
Q_{água} + Q_{gelo} = 0
underbrace {m cdot c cdot Delta T }_{água} + underbrace { left( m cdot L + m cdot c cdot Delta T right) }_{gelo} = 0
m_{água} cdot c_{água} cdot Delta T_{água} + left( m_{gelo} cdot L_{gelo} + m_{gelo} cdot c_{água} cdot Delta T_{água_{gelo}} right)= 0
Sendo m_{cubo} a massa do cubo de gelo e n o número de cubos, temos:
m_{água} cdot c_{água} cdot Delta T_{água} + left( n cdot m_{cubo} cdot L_{gelo} + n cdot m_{cubo} cdot c_{água} cdot Delta T_{água_{gelo}} right)= 0
m_{água} cdot c_{água} cdot left( T_{água}^{final} - T_{água}^{inicial} right)+ left( n cdot m_{cubo} cdot L_{gelo} + n cdot m_{cubo} cdot c_{água} cdot left( T_{água_{gelo}}^{final} - T_{água_{gelo}}^{inicial} right) right)= 0
Substituindo os valores do enunciado na equação:
900 cdot 1 cdot left( 10 - 30 right) + left( n cdot 50 cdot 80 + n cdot 50 cdot 1 cdot left( 10 - 0 right) right) = 0
-18000 + 4000 n + 500 n = 0
4500 n = 18000
n = 4
Portanto, a resposta correta é a alternativa (c).
2088) 5 moles de oxigênio estão em equilíbrio termodinâmico, contidos em um recipiente que possui um êmbolo que pode deslizar em seu interior com atrito desprezível.
- A) 50cal.
- B) 100cal.
- C) 150cal.
- D) 200cal.
- E) 250cal.
A alternativa correta é letra B) 100cal.
Gabarito: LETRA B.
Para encontrar a variação de energia interna do oxigênio durante essa expansão, podemos usar a primeira lei da termodinâmica, que relaciona a variação de energia interna (Delta U), o calor fornecido (Q), e o trabalho realizado (W) pelo gás:
Delta U = Q - W tag 1
De acordo com o enunciado, o calor foi fornecido de forma isobárica (a pressão constante). Logo, o trabalho realizado pelo gás é dado por:
W = P Delta V
Onde P é a pressão constante e Delta V é a variação de volume. Substituindo W na equação (1), temos:
Delta U = Q - P Delta V tag 2
O volume é dado pela equação dos gases ideais:
PV=nRT
Ou, ainda,
V= dfrac { nR }{ P } cdot T
Então, se a pressão é constante, a variação de volume é dada por:
Delta V= dfrac { nR }{ P } Delta T tag 3
Substituindo a equação (3) na equação (2), temos:
Delta U = Q - cancel P cdot dfrac { nR }{ cancel P } Delta T
Delta U = Q - nR Delta T
A diferença de temperatura em Kelvin é a mesma que a diferença de temperatura em graus Celsius. Isso significa que um acréscimo de 5°C é equivalente a um acréscimo de 5 K. Assim, substituindo os valores do enunciado, temos:
Delta U = 150 , cal - 5 cancel {mol} cdot 2,0 dfrac { cal } { cancel {mol} cdot cancel K} cdot 5 cancel K
Delta U = 150 , cal - 50 , cal
Delta U = 100 , cal
Portanto, a resposta correta é a alternativa (b).
2089) No laboratório de Física, o técnico ficou com a tarefa de fazer um experimento para determinar a massa de alumínio a 25°C que ele deve colocar em um calorímetro para esfriar a água a 70°C. O calorímetro possui capacidade térmica 40 cal/°C e contém 100 g de água a 110°C. Assinale a alternativa que apresenta o valor, aproximadamente, que o técnico encontrou.
- A) 727,3 g
- B) 785,5 g
- C) 600,2 g
- D) 550,7 g
- E) 400,6 g
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Inicialmente devemos calcular a variação de energia do calorímetro:
Delta{E}=CDelta{t}
Delta{E}=40times(70-110)=-1600,Cal
Variação de energia da água:
Q=mcDelta{T}
Q=100cdot1cdot(70-110)=-4000,Cal
Variação de energia do alumínio:
Q=mcDelta{T}
Q=mcdot0,22(70-25)=9,9m
Como a energia adquirida pelo alumínio deve ser igual a energia cedida pela água e pelo calorímetro, logo:
9,9m=4000+1600=5600
boxed{mapprox 565,g}
Como não há gabarito entre as alternativas, a questão foi anulada.
Gabarito: ANULADA
2090) Relacione as colunas e assinale a alternativa com a sequência correta.
- A) 1 – 2 – 3.
- B) 2 – 3 – 1.
- C) 2 – 1 – 3.
- D) 1 – 3 – 2.
- E) 3 – 2 – 1.
A alternativa correta é letra B) 2 – 3 – 1.
Vejamos a definição de cada fenômeno:
1. Convecção. É quando o calor é transmitido pelo deslocamento de fluídos com densidades e temperaturas diferentes.
2. Irradiação. É quando o calor é transferido por meio da emissão de energia eletromagnética.
3. Condução. Na condução, ocorre a transferência de energia cinética entre as partículas e consequentemente a transferência de calor devido a agitação molecular.
Gabarito: B
