Questões Sobre Termologia - Física - concurso
2091) Uma fonte de calor fornece 100 cal a cada minuto. 500 ml de um líquido é aquecido por essa fonte de calor durante 30 minutos e sua temperatura sai de 25°C para 75°C. Assinale a alternativa que apresenta o valor da capacidade térmica dessa quantidade de líquido.
- A) 20 cal/°C.
- B) 30 cal/°C.
- C) 40 cal/°C.
- D) 50 cal/°C.
- E) 60 cal/°C.
A alternativa correta é letra E) 60 cal/°C.
A capacidade térmica C de uma substância é dada pela seguinte expressão:
C=frac{Q}{Delta{T}}
C=frac{100times30}{75-25}
C=frac{3000}{50}=60,Cal/^oC
Gabarito: E
2092) Um experimento de laboratório propõe construir um termômetro X mais preciso que o da escala Celsius. Para isso, ele dobra a variação de escala no intervalo entre os pontos de fusão e ebulição da água. Sabe-se que a temperatura que as duas escalas fornecem o mesmo resultado é TC=TX=-200. Quais foram as temperaturas escolhidas na escala X para os pontos de fusão e ebulição da água?
- A) 200 e 400.
- B) 100 e 300.
- C) 0 e 200.
- D) -100 e 100.
A alternativa correta é letra A) 200 e 400.
Pessoal, apesar de estranho o enunciado, o que a questão quis dizer é
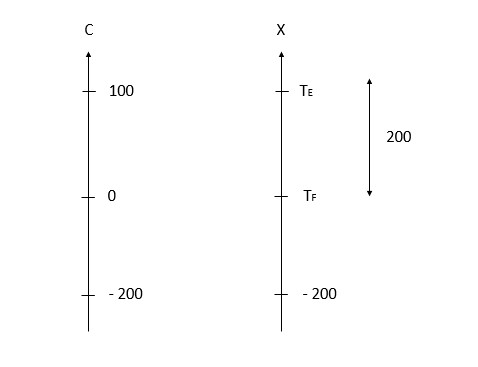
Logo,
dfrac{100 - 0} {0 - (-200)} = dfrac{T_E - T_F} {T_F - (-200)}
dfrac{100}{200} = dfrac{200} {T_F + 200}
T_F = 200
T_E = 200 + 200 = 400
Gabarito: LETRA A.
2093) Um calorímetro pode ser feito com um isopor para latinhas de cerveja e uma latinha. Para determinar a capacidade térmica do calorímetro a 10 °C, adiciona-se 100 g de água a uma temperatura de 20 °C e uma peça metálica de massa 200 g a uma temperatura de 90 °C. Seu equilíbrio térmico foi atingido a 30 °C. Qual é a capacidade térmica do calorímetro em cal/°C?
- A) 2,0.
- B) 10,0.
- C) 20,0.
- D) 100,0.
A alternativa correta é letra B) 10,0.
Pessoal, precisamos aplicar a fórmula de calor.
Q = (m c Delta T)_{agua} +(C Delta T)_{calor} + (m c Delta T)_{peca}
0 = 100 times 1 times (30 - 20) + C times (30 - 10) + 200 times 0,1 times (30 - 90)
0 = 1.000 + 20 C - 1.200
C = 10 , cal/° C
Gabarito: LETRA B.
2094) Usando uma régua metálica calibrada em 20 °C, um estudante distraído fez algumas medições. Em um dia em que o laboratório estava a uma temperatura média de 36 °C, o estudante mediu o comprimento do tampo da mesa com essa régua e encontrou 1,20 m como resultado. Qual é o tamanho real da peça medida pelo estudante?
- A) 1200,77 mm.
- B) 1200,38 mm.
- C) 1199,62 mm.
- D) 1199,23 mm.
A alternativa correta é letra B) 1200,38 mm.
Pessoal, indo direto ao ponto.
Delta L = L_0 alpha Delta T
L - L_0 = L_0 alpha Delta T
1.200 - L_0 = L_0 times 20 times 10^{-6} times (20 - 36)
Reparem no jogo de sinais da variação de temperatura pessoal. A temperatura do tampo tem que ser menor que a real, visto que foi medido a uma temperatura maior do que o calibrado.
1.200 = L_0 - 3,2 times 10^{-4} times L_0
0,99968 L_0 = 1.200
L_0 = 1.200,38 , mm
Gabarito: LETRA B.
2095) Em um experimento de calorimetria, foram adicionados 200 g de água a uma temperatura de 40 °C a um calorímetro de capacidade térmica 15 cal/°C que estava em temperatura ambiente de 25 °C. Em seguida, foram adicionados 100 g de gelo a uma temperatura de -10 °C. Qual foi a temperatura de equilíbrio atingida pelo sistema em graus Celsius?
- A) 5,92.
- B) 8,42.
- C) 9,25.
- D) 35,92.
A alternativa correta é letra C) 9,25.
Pessoal, aplicação direta da fórmula de conservação de calor transferido.
Q_{ag} + Q_{gelo} + Q_{calor} = 0
200 times 1 times (T_f - 20) + 100 times 0,5 times (T_f - (-10)) + 100 times 80 + 15 times (T_f - 25) = 0
Reparem nos dois termos centrais no qual temos o aquecimento do gelo e também sua fusão: Q_{gelo} = m c Delta T + m L
Desenvolvendo e reorganizando vamos chegar a
265 T_f = 3.075
T_f = 11,60 , °C
O gabarito da questão foi a alternativa C, que destoa bastante do valor encontrado.
Gabarito: LETRA C.
Gabarito do Professor: ANULADA.
2096) Considere os seguintes valores para algumas constantes termodinâmicas: calor específico do gelo = 2.220 J/kg∙K;calor latente de fusão da água = 333 kJ/kg; calor específico da água = 4.180 J/kg∙K; constante universal dos gases ideais = 8,31 J/mol∙K; e 0,4 para ln 1,5.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Gabarito: CERTO.
A Primeira Lei da Termodinâmica estabelece que a variação da energia interna de um sistema (Delta U) é igual à diferença entre o calor (Q) adicionado ao sistema e o trabalho (W) realizado pelo sistema:
Delta U = Q - W
Em processos adiabáticos, não há trocas de calor entre o sistema e o ambiente, ou seja, Q = 0. Assim, a equação acima se torna:
Delta U = 0 - W
Delta U = - W
Então, podemos escrever:
left| Delta U right| = left| - W right|
left| Delta U right| = W
Isso significa que a variação da energia interna do sistema é igual, em módulo, ao trabalho realizado pelo sistema.
Portanto, o item está certo.
2097) Certa massa m de um líquido, de calor específico c, encontra- se a uma temperatura de 15 ºC no interior de um frasco de capacidade térmica C. O sistema está isolado do meio e deve receber calor de um aquecedor ôhmico, de potência P (em watts), a uma tensão de 220 V. Ao se conectar o aquecedor a uma tomada, verifica-se que a tensão na rede elétrica é de 110 V. Assim mesmo a ligação é efetuada. Para se prever o intervalo de tempo ∆t necessário para elevar a temperatura do sistema até 95 ºC, e considerando o equivalente mecânico do calor J, a expressão que permite determiná-lo, em função dos dados, deve ser:
- A) Delta t={large{80.J.(m.c+C) over P}}
- B) Delta t={large{320.J.(m.c+C) over P}}
- C) Delta t=80.J.P.(m.c+C)
- D) Delta t={large{80.P.(m.c+C) over J}}
- E) Delta t={large{320.P.(m.c+C) over J}}
A alternativa correta é letra B) Delta t={large{320.J.(m.c+C) over P}}
Pessoal, descartem as informações de voltagem pois não serão necessárias.
Q = m c Delta T + m C
P Delta t = m c (95 - 15) + C (95 - 15)
Delta t = dfrac { 80 ( m c + C) } { P }
Pessoal, a unidade de potências é Watts e o examinador quer em Cal (equivalente mecânico de joule) que é 4,2. Olhando o gabarito, eles colocaram o Cal como 4,0.
Delta t = dfrac { 80 ( m c + C) } { P/4,0 J}
Delta t = dfrac { 320 J ( m c + C) } { P }
Gabarito: LETRA B.
2098) Quando um fio é aquecido, seu comprimento aumenta graças ao aumento da movimentação de suas moléculas. Dessa forma, podemos dizer que o fio sofreu uma
- A) dilatação térmica linear.
- B) contração térmica linear.
- C) dilatação térmica superficial.
- D) contração térmica volumétrica.
- E) dilatação térmica volumétrica.
A alternativa correta é letra A) dilatação térmica linear.
Vamos às alternativas:
a) dilatação térmica linear. Verdadeiro.
b) contração térmica linear. Falso, é dilatação.
c) dilatação térmica superficial. Falso, a dilatação ocorre em todo o interior do fio.
d) contração térmica volumétrica. Falso, pois ainda que ocorra uma dilatação no volume do fio, o tipo de dilatação que ocasiona aumento no comprimento do fio é a dilatação linear.
e) dilatação térmica volumétrica. Falso, vide item D.
Gabarito: A
Questão 2099
Um determinado material foi submetido a um processo de aquecimento para estudar o seu comportamento em relação ao seu ponto de ebulição. O resultado verificado foi registrado em um gráfico como representado a seguir.
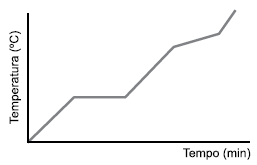
Os alunos pesquisaram diferentes materiais e seu comportamento durante as mudanças de estado físico. Analisando os dados do gráfico, os alunos indicaram que um material que apresenta o tipo de comportamento registrado no gráfico é considerado uma
- A) liga metálica homogênea, como o latão.
- B) substância pura, como o sal de cozinha.
- C) solução homogênea, como água e açúcar.
- D) mistura heterogênea, como o petróleo.
- E) mistura homogênea, como água e sal.
A alternativa correta é letra A) liga metálica homogênea, como o latão.
Se estivermos aquecendo ou resfriando uma mistura, o ponto de fusão e o ponto de ebulição não terão valores determinados e constantes, ou seja, não se formarão os dois patamares observados nos gráficos abaixo.
As mudanças de estados físicos ocorrerão em faixas de temperatura, e não em um valor fixo. O ponto de fusão, por exemplo, começará em uma dada temperatura e terminará em outra, e o mesmo ocorrerá com o ponto de ebulição, como mostrado no gráfico a seguir:
No entatanto, quando a mistura é do tipo eutética, ela comporta-se como se fosse uma substância pura durante a fusão, ou seja, nesse ponto, a temperatura mantém-se constante do início ao fim da mudança de estado de agregação. Veja a figura:
É o que ocorre com as ligas metálicas, a exemplo do latão.
Gabarito: A
Questão 2100
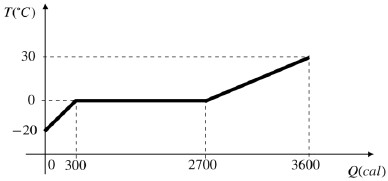
De acordo com o experimento, assinale a alternativa correta.
- A) O calor específico do gelo é 1,0 cal/g.oC.
- B) O calor latente de fusão do gelo é 80,0 cal/g.
- C) O calor específico da água é 0,5 cal/g.oC.
- D) Para transformar gelo em água sem alterar a temperatura, é preciso uma quantidade de calor igual a 2700 cal.
A alternativa correta é letra B) O calor latente de fusão do gelo é 80,0 cal/g.
Na processo de transformação do gelo em água, ou seja, na fusão, não ocorre mudança de temperatura. Essa situação está representada no gráfico. Logo, podemos escrever:
Q=mL
2700-300=30cdot L
L=frac{2400}{30}=80,Cal/g
Gabarito: B
