Questões Sobre Termologia - Física - concurso
2161) Para fazer certa massa de gelo fundente ser transformada em água no ponto de ebulição, é necessária determinada quantidade de calor. Para vaporizar a mesma quantidade de água, é necessária uma quantidade de calor
- A) igual.
- B) 3 vezes maior.
- C) 3 vezes menor.
- D) 5,4 vezes maior.
- E) 5,4 vezes menor.
A alternativa correta é letra B) 3 vezes maior.
Para a fusão do gelo
Q = m L_g
Q = 80 m
Para a vaporização da água
Q' = m c Delta T + m L_A
Q' = m times 1 times (100 - 0) + m times 540
Q' = 640 m
Reparem que o gelo já estava na temperatura de fusão. Já para irmos da água a 0 graus (acabou de "virar água") para a vaporização, temos as duas etapas (aquecimento m c Delta T e mudança de estado m LA)
Relacionando as duas,
n = dfrac{640m}{80m} = 8
A questão não tem gabarito.
Caso tentássemos relacionar apenas com os coeficientes de fusão e ebulição, chegaríamos em
n = dfrac{540 m}{ 80 m} = 6,75
Gabarito da Banca: LETRA B.
Gabarito do Professor: ANULADA.
2162) Considere uma porção de água utilizada para refrigeração de uma usina, em uma área de 1 km² com profundidade média de 10 m, em uma região próxima a ela, que, neste processo, tenha sofrido um aumento de temperatura de 1°C, configurando um exemplo de poluição térmica. Considere ainda o calor específico da água igual a 1 cal.g-1.°C-1 e sua densidade igual a 10³ kg/m³. A quantidade de calor retirada da usina para refrigeração pela água, neste caso, é, em calorias, da ordem de
- A) 107.
- B) 1010.
- C) 1011.
- D) 1013.
- E) 1015.
A alternativa correta é letra D) 1013.
Pessoal, o volume em metros cúbicos será
V = 10 times (10^3)^2 = 10^7 , m
Agora, precisamos calcular a massa,
rho = dfrac{m}{V}
m = 10^3 times 10^7 = 10^{10} , kg
Finalmente,
Q = m c Delta T
Q = 10^{10} times 10^3 times 1 = 10^{13} , J
Gabarito: LETRA D.
2163) Em relação aos conceitos de calor e temperatura, assinale a alternativa correta.
- A) Calor é a quantidade de energia térmica que um corpo possui.
- B) Temperatura é o grau de liberdade das moléculas.
- C) Equilíbrio térmico ocorre quando dois corpos possuem a mesma quantidade de energia térmica.
- D) A transferência de energia térmica não pode ocorrer no interior de um corpo.
- E) Dois corpos podem possuir quantidades de energia térmica diferentes e apresentar a mesma temperatura.
A alternativa correta é letra E) Dois corpos podem possuir quantidades de energia térmica diferentes e apresentar a mesma temperatura.
Vamos verificar afirmativa por afirmativa.
a) Calor é a quantidade de energia térmica que um corpo possui.
ERRADA. Calor é energia em fluxo pessoal.
b) Temperatura é o grau de liberdade das moléculas.
ERRADA. Quase, pessoal!. Temperatura é o grau de agitação das moléculas. Quando falamos em liberdade, nos aproximamos do conceito de entropia
c) Equilíbrio térmico ocorre quando dois corpos possuem a mesma quantidade de energia térmica.
ERRADA. Quando possuem a mesma temperatura.
d) A transferência de energia térmica não pode ocorrer no interior de um corpo.
ERRADA. Pessoal, se tivermos diferentes temperaturas em dois pontos distintos, teremos transferência de energia.
e) Dois corpos podem possuir quantidades de energia térmica diferentes e apresentar a mesma temperatura.
CORRETA. Se pegarmos uma molécula de água e um gás como o nitrogênio a mesma temperatura, a água terá mais energia armazenada, devido a suas fortes interações moleculares.
Gabarito: LETRA E.
2164) Considere aquecer uma certa quantidade de água, tendo duas opções disponíveis: aquecimento direto pela combustão de gasolina e uso de um gerador elétrico alimentado por gasolina.
- A) O gerador elétrico consumirá mais de 1 litro de gasolina para alcançar o mesmo aquecimento que 1 litro de gasolina por combustão direta.
- B) O gerador elétrico consumirá exatamente a mesma quantidade de gasolina que a combustão direta.
- C) O gerador elétrico consumirá menos de 1 litro de gasolina para alcançar o mesmo aquecimento que 1 litro de gasolina por combustão direta.
- D) O gerador elétrico não é capaz de aquecer a água até 55 °C, independentemente da quantidade de gasolina consumida.
- E) A quantidade de gasolina necessária para o gerador elétrico não pode ser determinada com as informações fornecidas.
A alternativa correta é letra A) O gerador elétrico consumirá mais de 1 litro de gasolina para alcançar o mesmo aquecimento que 1 litro de gasolina por combustão direta.
Pessoal, vamos verificar a primeira opção
Q = m c Delta T
Q = 200 times 10^3 times 4,19 times (55 - 20 )
Q = 29.330.000 , J
Agora, para o gelador elétrico,
P = i U
U = R i
Logo,
P = dfrac{U^2}{R} = dfrac{110^2}{11} = 1.100 , W
Relacionando a energia do primeiro, com a potência do segundo, teremos,
P = dfrac{ Delta E } { Delta t }
t = dfrac{29.330.000}{1.100} = 26.663,6 , s
Dividindo por 3.600 segundos (1 hora),
t = 7,4 , h
Gabarito: LETRA A.
2165) Sabe-se que o estado físico da matéria pode ser alterado por variações de temperatura e pressão, sem que haja alteração na composição da matéria. Algumas mudanças de estado físico ocorrem com a liberação de calor, processos denominados exotérmicos como, por exemplo,
- A) fusão.
- B) ebulição.
- C) vaporização.
- D) solidificação.
A alternativa correta é letra D) solidificação.
Pessoal as três primeiras alternativas contemplam processos endotérmicos.
Ou seja, absorvem calor.
Quando temos a passagem de
Sólido para líquido
Líquido para gasoso
Temos comportamento endotérmico (estamos absorvendo calor).
O caminho inverso, é processo exotérmico (libera calor).
Logo,
Gabarito: LETRA D.
Questão 2166
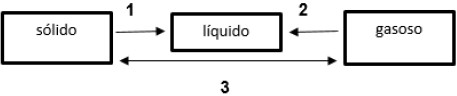
As mudanças representadas por 1, 2 e 3 são, respectivamente:
- A) Fusão; condensação; e, sublimação.
- B) Fusão; condensação; e, vaporização.
- C) Liquefação; vaporização; e, sublimação.
- D) Liquefação; vaporização; e, condensação.
A alternativa correta é letra A) Fusão; condensação; e, sublimação.
Pessoal, observem os sentidos das setas.
Quando temos a passagem de sólido para líquido temos fusão. Já eliminamos C e D.
Quando vamos do gasoso pro líquido temos condensação ou liquefação.
Por fim, quando temos a passagem direta de sólido para gasoso ou gasoso para sólido, chamamos de sublimação.
Gabarito: LETRA A.
2167) Um Professor de Ciências realizou um experimento no laboratório com seus alunos utilizando um gás ideal confinado em um cilindro com um êmbolo móvel. Ao aquecer o cilindro com um fogareiro, a classe observou todas as variações causadas no sistema.
- A) ΔP é diretamente proporcional a Delta U e inversamente proporcional a Q.
- B) ΔU é diretamente proporcional a Q, mas não depende de ΔP.
- C) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
- D) ΔP e ΔU são independentes de Q se o volume do gás não mudar.
- E) Q é inversamente proporcional a Delta P e diretamente proporcional a Delta U.
A alternativa correta é letra C) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
Pessoal, a lei que rege o experimento descrito é
Delta U = Q - W
Delta U = Q - P delta V
a) ΔP é diretamente proporcional a Delta U e inversamente proporcional a Q.
ERRADO. É diretamente proporcional a U e a Q.
b) ΔU é diretamente proporcional a Q, mas não depende de ΔP.
ERRADO. A primeira parte está correta. Porém, a segunda erra: a variação de energia depende da pressão.
c) Q é diretamente proporcional a Delta U, e Delta P aumenta se o volume permanecer constante.
CORRETA. Reparem que ao aquecermos, se não variarmos o volume a pressão tem que aumentar.
d) ΔP e ΔU são independentes de Q se o volume do gás não mudar.
ERRADO. São sim dependentes.
e) Q é inversamente proporcional a Delta P e diretamente proporcional a Delta U.
ERRADO. Se Q aumenta P e U aumentam também.
Gabarito: LETRA C.
2168) Em um experimento de calorimetria, 100 g de água inicialmente a 20ºC são postos em contato com um pedaço de 400 g de Alumínio que inicialmente estava a 80ºC. Por distração, esquece-se inicialmente de se fechar a tampa do calorímetro, o que é posteriormente corrigido. Observa-se que a temperatura de equilíbrio final do sistema é de 40ºC. Usando os valores aproximados para o calor específico da água de 4000 J/(Kg.K) e para o Alumínio de 1000 J/(Kg.K), determine o quanto de calor foi perdido pelo sistema formado pela água e pelo Alumínio entre o instante inicial e o instante final.
- A) 0 kJ
- B) 4 kJ
- C) 8 kJ
- D) 16 kJ
- E) 24 kJ
A alternativa correta é letra C) 8 kJ
Pessoal vamos fazer separadamente.
O que foi perdido é a diferença do calor que a água ganhou (visto que ela vai aquecer) e o calor cedido pelo alumínio (vai resfriar).
Logo, aplicando
Q = m c Delta T
Vamos ter para a água,
Agora, para o alumínio,
Reparem que a diferença será
Delta Q = 16 - 8 = 8,0 , kJ
Gabarito: LETRA C.
Questão 2169
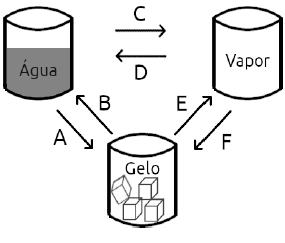
Afirma-se:
I – Os processos A e D podem ocorrer mesmo não havendo mudanças de temperatura, desde que a pressão seja suficientemente aumentada.
II – Os processos E e F nunca ocorrem.
III – Em uma panela de pressão, o processo C ocorre a temperaturas inferiores a 100⁰C, por isso há uma maior produção de vapor do que em uma panela convencional.
Está(ão) correta(s) apenas a(s) afirmação (ões):
- A) I
- B) II
- C) I, II e III
- D) I e III
- E) II e III
A alternativa correta é letra A) I
Vamos verificar afirmativa por afirmativa
CORRETA. Realmente, pessoal. Se só fornecemos calor para derreter ou retirar para congelar sem excesso pode ocorrer a temperatura constante. Discordo entretanto da segunda parte que afirma que a pressão tem que ser suficientemente aumentada.
Entretanto, a banca considerou correta.
II - Os processos E e F nunca ocorrem. ERRADA. Ocorrem e inclusive recebem o mesmo nome: Sublimação.
III - Em uma panela de pressão, o processo C ocorre a temperaturas inferiores a 100⁰C, por isso há uma maior produção de vapor do que em uma panela convencional. ERRADA. Em panela de pressão a temperatura é bem maior, visto que a pressurização aumenta a temperatura de ebulição da água, de forma a cozinhar os alimentos por mais tempo.
Gabarito da Banca: LETRA A.
Gabarito do Professor: ANULADA.
2170) A avaliação do calor latente de fusão de substâncias é uma tarefa experimentalmente complicada, devido às análises de perdas e trocas de calor com o ambiente. Uma abordagem mais simples envolve atividades de simulação, nas quais são feitas simplificações para facilitar a compreensão dos conceitos relacionados. Considere uma simulação em que há um calorímetro ideal contendo 350 ml de água (densidade de 1 g/ml) a uma temperatura de 80 °C. No calorímetro, são adicionados 50 g de gelo a 0 °C. Considerando que ocorrem trocas de calor apenas entre a água e o gelo, qual será a temperatura final do sistema? Considere o calor latente de fusão do gelo igual a 80 cal/g e o calor específico da água como sendo 1 cal/g°C.
- A) 40 °C.
- B) 53 °C.
- C) 60 °C.
- D) 76 °C.
- E) 80 °C.
A alternativa correta é letra C) 60 °C.
Pessoal, vamos por partes.
A água vai fornecer para o gelo um total de
Q = m c Delta T = 28.000 , cal
Desse valor, parte irá descongelar o gelo sem alteração de temperatura
Q = m L
Q = 4.000 , cal
Agora, a sobra de energia 28.000 - 4.000 = 24.000 será utilizada para o equilíbrio térmico.
Q = m c Delta T
24.000 = 400 times 1 times Delta T
T = 60 ^o C
Gabarito: LETRA C.
