Questões Sobre Termologia - Física - concurso
211) O gráfico que melhor representa a expansão de uma amostra de gás ideal a pressão constante é:
- A)
- B)
- C)
- D)
A alternativa correta é letra A)
Pela equação geral dos gases, equação de Clapeyron, temos:
frac{pcdot V}{T}=ncdot R
pcdot V=ncdot RT=constante
Portanto, observa-se que o produto PV (pressão times volume) é uma constante. Desse modo, o gráfico que melhor representa a amostra dessa gás será a reta da alternativa A.
Gabarito: A
Questão 212
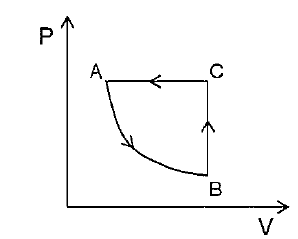
O gráfico acima representa um gás ideal descrevendo um ciclo ABC em um diagrama PxV. Esse ciclo consiste em uma transformação isotérmica seguida de uma transformação ISOCÓRICA e uma isobárica. Em um diagrama VxT, qual gráfico pode representar o mesmo ciclo ABC?
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra A)
Gabarito: LETRA A.
Para resolver essa questão, devemos lembrar da equação geral dos gases ideais:
dfrac { P cdot V } { T } = text{constante} tag 1
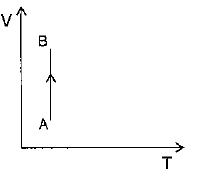
Observando o gráfico do enunciado, podemos verificar que, durante o processo isotérmico overrightarrow{AB}, há um aumento de volume a uma temperatura constante. Assim, em um diagrama VxT, o gráfico que representa o processo overrightarrow{AB} apresenta o seguinte trecho:
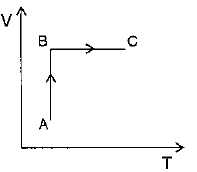
Ainda, podemos verificar que o processo overrightarrow{BC} é constituído de um aumento de pressão a volume constante. Logo, a equação (1) se torna:
dfrac { P cdot cancel V } { T } = text{constante}
dfrac { P } { T } = text{constante}
P = text{constante} cdot T
Ou seja, nesse caso, um aumento da pressão é seguido por um aumento na temperatura. Dessa forma, em um diagrama VxT, o processo overrightarrow{BC} é representado por:
Por fim, podemos verificar que o processo overrightarrow{CA} é constituído de uma diminuição de volume a pressão constante. Logo, a equação (1) se torna:
dfrac { cancel P cdot V } { T } = text{constante}
dfrac { V } { T } = text{constante}
V = text{constante} cdot T
Assim, nesse caso, uma diminuição de volume é seguida por uma diminuição de temperatura. Ou seja, ambos diminuem seguindo uma relação linear. Dessa forma, em um diagrama VxT, o processo overrightarrow{CA} é representado por:
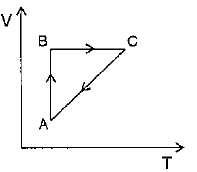
Portanto, a resposta correta é a alternativa (a).
Questão 213
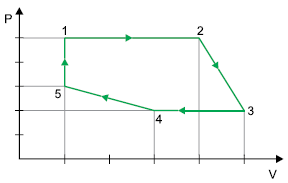
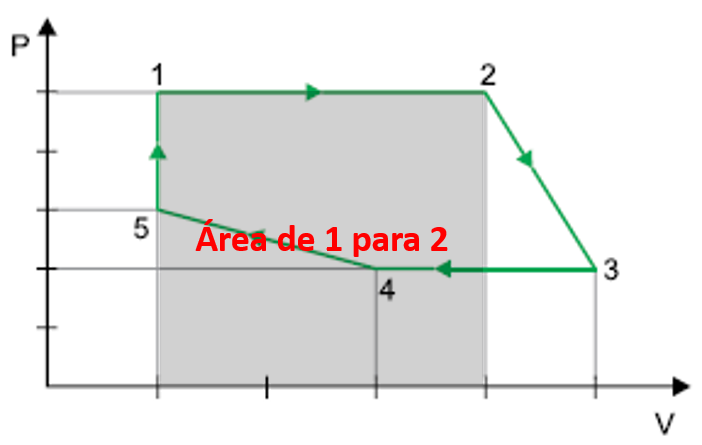
O trecho em que a força exercida pelo gás realiza o maior trabalho é
- A) 2-3.
- B) 4-5.
- C) 3-4.
- D) 1-2.
- E) 5-1.
A alternativa correta é letra D) 1-2.
ALTERNATIVA CORRETA: LETRA D
O trecho em que a força exercida pelo gás realiza o maior trabalho é de 1 para 2, pois será o trecho com maior área, logo apresentará o maior trabalho.
214) Um cilindro contém um gás em baixa densidade, que podemos considerar como gás ideal. Através de um pequeno orifício no cilindro ocorre escoamento de gás para o meio externo.
- A) PV=2P'V'
- B) PV=3P'V'
- C) PV=4P'V'
- D) PV=5P'V'
- E) PV=6P'V'
A alternativa correta é letra A) PV=2P'V'
Pela equação de Clapeyron temos que:
PV=nRT
Onde n é o número de mols do gás e R é a constante universal dos gases ideais. A temperatura T também é constante conforme nos informa o enunciado. O número de mols é igual a n=frac{m}{mu}, onde mu é a massa molar do gás. Logo:
P'V'=frac{m}{2mu}RT
frac{P'V'}{frac{m}{2}}=frac{RT}{mu}=constante tag 1
PV=frac{m}{mu}RT
frac{PV}{m}=frac{RT}{mu}=constantetag 2
Comparando (1) e (2) teremos:
frac{P'V'}{frac{m}{2}}=frac{PV}{m}
boxed{PV=2P'V'}
Analisando as alternativas, concluímos que o gabarito é a letra A.
Gabarito: A
215) A primeira lei da termodinâmica pode ser considerada como outra forma de enunciar a lei da conservação da energia, ou seja, a variação de energia de um sistema é igual à diferença entre a energia recebida pelo sistema e a energia fornecida por um sistema. A respeito da primeira lei da termodinâmica, julgue o próximo item.
- A) Certo
- B) Errado
A resposta correta é a letra B) Errado.
Para entender por que a resposta é errada, é necessário analisar a primeira lei da termodinâmica. A primeira lei da termodinâmica estabelece que a variação de energia de um sistema é igual à diferença entre a energia recebida pelo sistema e a energia fornecida pelo sistema. Matematicamente, isso pode ser representado pela equação:
ΔE = Q - W
Onde ΔE é a variação de energia do sistema, Q é a energia recebida pelo sistema e W é a energia fornecida pelo sistema.
No caso do problema, o gás é aquecido e descreve uma reta vertical em um diagrama PV do estado inicial (2,0 × 10^5 Pa e 4 m^3) ao estado final (5,0 × 10^5 Pa e 3 m^3). O trabalho realizado pelo gás sobre o ambiente é de 900 kJ.
Para determinar se a afirmativa está correta ou não, é necessário analisar se o trabalho realizado pelo gás sobre o ambiente é igual à variação de energia do sistema. No entanto, como o problema não fornece a variação de energia do sistema, não é possível determinar se a afirmativa está correta ou não.
Portanto, a resposta correta é a letra B) Errado, pois não há informações suficientes para determinar se a afirmativa está correta ou não.
216) Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
- A) I
- B) II
- C) III
- D) IV
A alternativa correta é letra B) II
Sabemos que quanto maior é o volume, menor a pressão a qual um mesmo gás está submetido. Sendo assim, o menor volume é aquele que possui o menor raio.
a) I
ERRADA. 1,0 R
b) II
CORRETA. 0,5 R (menor valor)
c) III
ERRADA. 2 R
d) IV
ERRADA. 0,67 R
217) Em um gás ideal, o produto da pressão pelo volume dividido pela temperatura tem, no Sistema Internacional, unidade de medida de
- A) Pa/K.
- B) Nm/K.
- C) m3/K.
- D) Pa/m2.
A alternativa correta é letra B) Nm/K.
[Uni] = dfrac{dfrac {N}{m^2} times {m^3}}{K} = dfrac {N times m}{K}
Gabarito: LETRA B.
218) Um gás que possa ter sua temperatura, seu volume e sua pressão relacionados por PV = nRT apresenta as seguintes características:
- A) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões elásticas.
- B) distância média entre as moléculas muito pequena; moléculas sofrem colisões inelásticas.
- C) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões inelásticas.
- D) distância média entre as moléculas muito grande e com fortes interações intermoleculares; moléculas sofrem colisões elásticas.
A alternativa correta é letra A) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões elásticas.
Vejamos o que nos diz a teoria cinética dos gases ideais. Ela é constituída pelos seguintes postulados:
1º. As partículas que compõem um gás se encontram muito afastadas umas das outras, em outras palavras, os espaços “vazios” que existem entre elas é bem maior do que o espaço que as mesmas ocupam. Devido ao afastamento entre as partículas, elas se interagem pouco, por isso, os gases se expandem facilmente e se dilatam com o calor. Essa distância entre as partículas também explica a baixa densidade dos gases, a sua facilidade de compressão e o porquê de serem completamente miscíveis entre si.
2º. As partículas dos gases se movimentam de forma rápida, contínua e desordenada, em todas as direções, chocando-se entre si e contra as paredes internas dos recipientes em que estão contidas, sem perda de energia cinética e de quantidade de movimento. Isso determina a pressão exercida pelo gás: quanto maior o número de colisões das partículas contra as paredes do recipiente, maior a pressão que o gás exerce sobre tal recipiente. São os choques das partículas dos gases que faz com que um balão se mantenha cheio, por exemplo.
3º. A energia cinética média das partículas gasosas é diretamente proporcional à temperatura do gás. Assim, sob a mesma temperatura, todos os gases apresentam a mesma energia cinética média, independente da sua massa molecular.
4º. As partículas dos gases se interagem apenas quando se chocam, logo, elas praticamente não exercem força sobre as outras.
Analisemos cada uma das alternativas:
Um gás que possa ter sua temperatura, seu volume e sua pressão relacionados por PV = nRT apresenta as seguintes características:
a) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões elásticas. Correto. Colisões elásticas são aquelas onde não há perda de energia cinética.
b) distância média entre as moléculas muito pequena; moléculas sofrem colisões inelásticas. Falso. A distância média entre as moléculas é grande.
c) distância média entre as moléculas muito grande de modo a desprezar as interações intermoleculares, exceto ao colidirem; moléculas sofrem colisões inelásticas. Falso. As moléculas sofrem colisões elásticas.
d) distância média entre as moléculas muito grande e com fortes interações intermoleculares; moléculas sofrem colisões elásticas. Falso. Devido ao afastamento entre as moléculas ser muito grande, há fraca interação intermolecular.
Gabarito: A
219)
- A) A temperatura da massa de gás no estado A é maior do que no estado B.
- B) A variação da energia interna do gás no “caminho” I é maior do que no “caminho” II.
- C) A quantidade de calor trocada pela massa de gás no “caminho” I é igual a 4,15.104J.
- D) O trabalho realizado pela massa de gás no “caminho” II tem módulo igual a 6,0.103J.
- E) A quantidade de calor trocada pela massa de gás no “caminho” II é da ordem de 104J.
A alternativa correta é letra E) A quantidade de calor trocada pela massa de gás no “caminho” II é da ordem de 104J.
Vamos verificar afirmativa por afirmativa.
a) A temperatura da massa de gás no estado A é maior do que no estado B.
ERRADO.
dfrac{ P_A V_A } { T_A } = dfrac{ P_B V_B } { T_B }
dfrac{ 7 times 2 } { T_A } = dfrac{ 4 times 3,5} { T_B }
14 T_B = 14 T_A
T_A = T_B
Reparem que são iguais.
b) A variação da energia interna do gás no “caminho” I é maior do que no “caminho” II.
ERRADO. Pessoal, como a variação depende diretamente da variação de temperatura, a afirmativa está errada. Temperaturas iguais geram diferença de energia interna nula.
c) A quantidade de calor trocada pela massa de gás no “caminho” I é igual a 4,15.104J.
ERRADO.
Delta U = Q - W
O = Q - W
Q = W
Q = p Delta V
Q = = 4 times 10^4 times 1,5 times 10^{-1} = 6.000 , J
d) O trabalho realizado pela massa de gás no “caminho” II tem módulo igual a 6,0.103J. ERRADO. Reparem que esse é o trabalho do caminho 1. No caminho II
tau = 7 times 10^4 time 1,5 times 10^{-1} = 10.500 , J
e) A quantidade de calor trocada pela massa de gás no “caminho” II é da ordem de 104J.
CORRETA. Reparem que é igual ao trabalho calculado anterior. Podemos aproximar 10.500 = 104.
Gabarito: LETRA E.
Questão 220

- A) 7,5
- B) 9,0
- C) 15,0
- D) 37,5
A alternativa correta é letra A) 7,5
Basta igualar as fórmulas de trabalho para as duas situações descritas. Chamando de inicial as condições em que não há injeção de ar e de final a condição de ar injetado, temos:
(p times S)_{inicial} = (p times S)_{final}
1,0 times 45 = 1,2 times S
S = 37,5 , cm
Delta S = 45 - 37,5 = 7,5 , cm
Gabarito: LETRA A.









