Questões Sobre Termologia - Física - concurso
221) “O volume de um gás confinado num sistema fechado, quando submetido a uma temperatura constante, é inversamente proporcional à pressão exercida sobre ele”. É a definição da:
- A) Lei de Dalton.
- B) Lei de Boyle.
- C) Lei de Faraday.
- D) Lei de Gay-Lussac.
A alternativa correta é a letra B) Lei de Boyle.
A afirmação da questão está correta. Quando um gás é confinado num sistema fechado e submetido a uma temperatura constante, seu volume é inversamente proporcional à pressão exercida sobre ele. Isso significa que, se a pressão sobre o gás aumenta, seu volume diminui, e vice-versa.
A Lei de Boyle, também conhecida como lei de Boyle-Mariotte, é uma lei da termodinâmica que descreve o comportamento de gases ideais. Ela estabelece que, a temperatura constante, o volume de um gás é inversamente proporcional à pressão exercida sobre ele. Matematicamente, isso pode ser representado pela fórmula:
$$P_1V_1 = P_2V_2$$
Onde $P_1$ e $P_2$ são as pressões iniciais e finais do gás, respectivamente, e $V_1$ e $V_2$ são os volumes iniciais e finais do gás, respectivamente.
A Lei de Boyle é fundamental em física e engenharia, pois permite calcular as propriedades de gases em diferentes condições de pressão e temperatura.
As outras opções não são corretas porque:
- A Lei de Dalton se refere à pressão parcial de uma mistura de gases.
- A Lei de Faraday se refere à relação entre a quantidade de elétrons transferidos e a quantidade de substância química.
- A Lei de Gay-Lussac se refere à relação entre a pressão e a temperatura de um gás ideal.
Portanto, a resposta correta é a letra B) Lei de Boyle.
222) Um mol de um gás monoatômico ideal, que está inicialmente a uma temperatura To, sofre uma transformação isovolumétrica, de modo que a sua pressão triplica. Em seguida, o gás sofre uma nova transformação isotérmica, de modo que o seu volume dobra de valor nesta transformação. A quantidade de calor que o gás recebeu ao longo de todo o processo é igual a: Obs.: considere R a constante geral dos gases.
- A) RT_0ln2
- B) 3RT_0ln2
- C) frac{1}{2}RT_0ln2
- D) 3RT_0(1+ln2)
- E) frac{3}{2}RT_0(1+ln2)
Para resolver essa questão, precisamos aplicar os conceitos de termodinâmica. Vamos quebrar o processo em dois estágios: o primeiro é a transformação isovolumétrica e o segundo é a transformação isotérmica.
No primeiro estágio, a pressão do gás triplica. Como a temperatura inicial é To, podemos aplicar a equação de estado dos gases ideais:
$PV = nRT$
Como o volume é constante (V = V0), podemos reescrever a equação como:
$P = frac{nRT}{V}$
Como a pressão triplica, podemos escrever:
$3P_0 = frac{nRT_1}{V_0}$
Onde T1 é a temperatura final do primeiro estágio. Podemos reorganizar a equação para encontrar T1:
$T_1 = 3T_0$
Agora, vamos para o segundo estágio, que é a transformação isotérmica. Nesse estágio, o volume dobra de valor. Podemos aplicar a equação de estado dos gases ideais novamente:
$P_1V_1 = nRT_1$
Como o volume dobra de valor (V1 = 2V0), podemos reescrever a equação como:
$P_1 = frac{nRT_1}{2V_0}$
Como a temperatura é constante (T1 = 3T0), podemos reorganizar a equação para encontrar P1:
$P_1 = frac{3}{2}P_0$
Agora, podemos calcular a quantidade de calor recebida pelo gás ao longo do processo. Podemos usar a equação:
$Q = nRT ln frac{V_1}{V_0}$
Substituindo os valores, obtemos:
$Q = nRT_0 ln frac{2V_0}{V_0} = 3nRT_0 ln 2 = 3RT_0 ln 2$
Portanto, a alternativa correta é a letra D) $3RT_0 (1 + ln 2)$.
A explicação para essa resposta é que, no primeiro estágio, o gás recebe calor para aumentar a pressão e, no segundo estágio, o gás recebe mais calor para dobrar o volume. A quantidade de calor recebida é proporcional ao aumento de temperatura e ao volume final.
223) Uma amostra de n mols de um gás ideal se expande isotermicamente, de modo que o seu volume triplica. Podemos afirmar que a variação da entropia neste processo é igual a:
- A) n.R.Ln(2)
- B) n.R.Ln(1/2)
- C) n.R.Ln(3)
- D) n.R.Ln(1/3)
- E) Zero
224) Assinale a opção que representa graficamente a relação entre a temperatura e a pressão de um gás considerado ideal, em ambiente fechado, em condição isocórica.
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra B)
A lei geral dos gases perfeitos nos diz que:
{p_1 V_1 over T_1} = {p_2 V_2 over T_2}
Em que p, V e T indicam pressão, volume e temperatura em diferentes estados.
Numa transformação isocórica, o volume é constante, ou seja, V_1 = V_2, de modo que a lei fica reduzida a:
{p_1 over T_1} = {p_2 over T_2}
Ou seja, a pressão é diretamente proporcional à temperatura. Isto significa que, quando a pressão aumenta, a temperatura aumenta na mesma proporção. Portanto, o gráfico que as relaciona é o de uma reta crescente, o que nos permite marcar a alternativa B.
Resposta: B
Questão 225
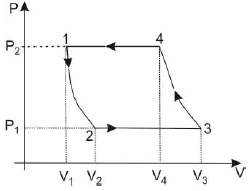
Essa máquina pode ser
- A) uma turbina a vapor.
- B) um aquecedor para chuveiro.
- C) uma geladeira.
- D) um motor a diesel.
- E) um motor a combustão interna.
A alternativa correta é letra C) uma geladeira.
Olhando o diagrama P x V, podemos notar que se trata de um ciclo inverso (flechas orientadas no sentido anti-horário). Um ciclo termodinâmico inverso busca o contrário do ciclo termodinâmico de obtenção de trabalho. É preciso trabalho externo ao ciclo para conseguir que a transferência de calor se produza da fonte mais fria à mais quente. Essa informação é suficiente para darmos como certa a alternativa C, geladeira. Pois é a única máquina térmica das alternativas que consome trabalho ao invés de entregar trabalho.
Em uma geladeira, o motor recebe energia de um reservatório frio e fornece energia para outro quente, o que pode ser feito somente se o trabalho for realizado sobre o motor. Podemos resumir da seguinte forma, a energia não é transferida espontaneamente por calor de um corpo frio para um corpo quente. É necessária a entrada de trabalho para que um refrigerador funcione.
Questão 226
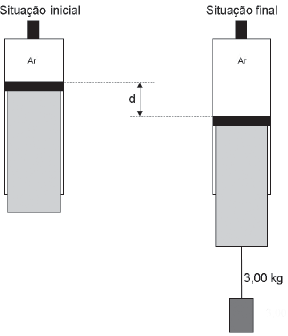
Considerando-se o ar um gás ideal que não vaza da seringa, a distância d entre as posições inicial e final do êmbolo da seringa, em cm, vale, aproximadamente:
- A) 1,00
- B) 3,33
- C) 4,44
- D) 5,33
- E) 16,7
A alternativa correta é letra B) 3,33
Vamos analisar a situação final da questão proposta. Quando a massa é pendurada, o ar dentro da seringa torna-se rarefeito, pois a mesma quantidade de ar ocupará uma área maior. O ar ficará “mais solto”, exercendo portanto uma pressão menor. Essa diferença de pressão é causada pela força peso da massa pendurada, assim podemos calcular da seguinte forma:
Delta P=dfrac{F}{A}=dfrac{m cdot g}{A_{seção}}=dfrac{3 cdot 10}{15 cm^2}=dfrac{30}{15 cdot 10^{-4} m^2}= 0,2 cdot 10^5 dfrac{N}{m^2}
Logo, a pressão na situação final é calculada como:
P_2 = P_1 - Delta P = 1,0 cdot 10^5 - 0,2 cdot 10^5
P_2 = 0,8 cdot 10^5 dfrac{N}{m^2}
Para encontrar o volume na situação final, podemos utilizar a equação geral de transformação dos gases ideais:
dfrac{P_1 cdot V_1}{T_1} = dfrac{P_2 cdot V_2}{T_2}
Como T_1 = T_2, temos:
V_2 = dfrac{P_1 cdot V_1}{P_2}
Na situação inicial, temos as seguintes condições:
V_1 = 200 cm^3 = 2,0 cdot 10^{-4} m^3
P_1 = 1,0 cdot 10^5 Pa
Logo,
V_2 = dfrac{P_1 cdot V_1}{P_2} = dfrac{1,0 cdot 10^5 times 2,0 cdot 10^{-4}}{0,8 cdot 10^5}
V_2 = 2,5 cdot 10^{-4} m^3
Assim, podemos calcular o deslocamento do êmbolo da seguinte maneira:
V_2 - V_1 = d cdot A_{seção}
d = dfrac {V_2 - V_1}{A_{seção}}
d = dfrac {2,5 cdot 10^{-4} - 2,0 cdot 10^{-4} m^3}{15 cdot 10^{-4} m^2}
d = 0,033 m
d = 3,3 cm
Portanto, a alternativa correta é a b.
227) Acerca das afirmações A1, A2 e A3 abaixo é CORRETO afirmar:
- A) A1, A2 e A3 são verdadeiras.
- B) A1 é falsa, A2 e A3 são verdadeiras.
- C) A1, A2 e A3 são falsas.
- D) A1 e A2 são falsas, A3 é verdadeira.
- E) A1 é verdadeira, A2 e A3 são falsas.
A alternativa correta é letra D) A1 e A2 são falsas, A3 é verdadeira.
Vamos analisar cada uma das afirmações:
A1- Considere que um cilindro de cobre de massa M, à temperatura de 80 ºC, é completamente mergulhado em água, a 20 ºC, contida num recipiente isolante de calor. Considere que a massa de água é igual à massa do cilindro de cobre. Sabendo que o calor específico da água é cerca de 10 vezes maior que o do cobre, a temperatura de equilíbrio da água será de 50 ºC. INCORRETA.
Como o sistema é isolado, podemos escrever:
Q_{água} + Q_{cobre} =0
Q_{água} = - Q_{cobre}
Onde Q = mc Delta theta, temos:
cancel M cdot c_{água} cdot ( theta_f - 20) =- cancel M cdot c_{cobre} cdot ( theta_f - 80)
Como c_{água} = 10 c_{cobre}, temos:
10 cancel {c_{cobre}} cdot ( theta_f - 20) =- cancel {cdot c_{cobre}} cdot ( theta_f - 80)
10 cdot theta_f - 10 cdot 20 = - theta_f + 80
11 cdot theta_f = 280
theta_f = dfrac {280}{11}
theta_f approx 25,45 °C
Portanto, a afirmação está incorreta.
A2- A quantidade de calor necessária para elevar a temperatura de um gás ideal em 1 ºC é menor sob pressão constante do que sob volume constante. INCORRETA.
A temperatura de um gás é associada ao grau de agitação das partículas desse gás e é proporcional à energia interna Delta U. De acordo com a primeira lei da termodinâmica, a variação da energia interna durante uma transformação é dada por:
Delta U=Q - W
Onde Q é o calor transferido para o sistema e W é o trabalho realizado pelo sistema. Assim, podemos escrever:
Q = Delta U + W
Em uma transformação sob volume constante, o trabalho realizado pelo sistema é zero. Assim, todo o calor transferido para o sistema é responsável pela variação da energia interna. Logo, podemos dizer que a quantidade de calor necessária para elevar a temperatura de um gás ideal em 1 ºC é MAIOR sob pressão constante do que sob volume constante.
A3- A pressão de um gás ideal em um container de volume constante é proporcional à energia cinética média das moléculas do gás. CORRETA.
De acordo com a teoria cinética dos gases, a pressão na superfície de contato de um gás é causado pela colisão de suas moléculas, que se movem devido à energia cinética média das moléculas do gás. Alternativa correta.
Portanto, a alternativa correta é a letra (D), as afirmações A1 e A2 são falsas, A3 é verdadeira.
Questão 228
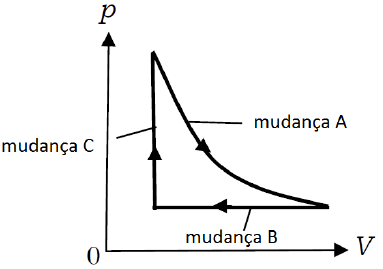
- A) a mudança A é isobárica, a mudança B é isocórica e a mudança C é isotérmica.
- B) a mudança A é isotérmica, a mudança B é isocórica e a mudança C é isobárica.
- C) a mudança A é isotérmica, a mudança B é isobárica e a mudança C é isocórica.
- D) a mudança A é isocórica, a mudança B é isobárica e a mudança C é isotérmica.
- E) a mudança A é isocórica, a mudança B é isotérmica e a mudança C é isobárica.
A alternativa correta é letra C) a mudança A é isotérmica, a mudança B é isobárica e a mudança C é isocórica.
A mudança A, a pressão é inversamente proporcional à temperatura. Essa transformação é chamada de isotérmica. Já na mudança B, a pressão se manteve constante, ou seja, a transformação é isobárica. Na mudança C, a pressão se manteve constante, o que chamamos de transformação isovolumétrica, também chamada de isocórica.
Portanto, a alternativa correta é a letra (C).
229) Um tanque contém gás a uma temperatura de 27 ºC, cujo peso unitário é de 400 N/m³. O manômetro do tanque indica uma pressão de 24 bar (1 bar = 10^5 Pa). Considerando que esse gás se comporta como um gás ideal, o valor para a constante R desse gás é:
- A) 200 m/K
- B) 0,0002 m/K
- C) 2000 m/K
- D) 2 m/K
- E) 20 m/K
A alternativa correta é letra E) 20 m/K
A lei geral dos gases é dada por:
PV = nRT
Assim, podemos encontrar a constante R do gás em questão da seguinte maneira:
R = dfrac {PV}{nT}
R = dfrac {P}{T} dfrac {V}{n}
A razão V/n é chamada de volume molar. É possível demonstrar que
P_{unitário} = dfrac{n}{V}
Logo, temos:
R = dfrac {P}{T} dfrac {1}{P_{unitário}}
R = dfrac {24 cdot 10^5 N/m^2}{ (27 + 273,15) K} dfrac {1}{400 N/m^3}
R = dfrac {24 cdot 10^5 m}{400 cdot 300 K}
R = 20 m/K
Portanto, o gabarito da questão é a alternativa (E).
230) Um mole de um gás monoatômico ideal, inicialmente a uma temperatura T, se expande de um volume V até um volume 2V em duas situações:
- A) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
- B) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é maior que o calor absorvido na situação (ii).
- C) O trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é maior que o calor absorvido na situação (ii).
- D) O trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
- E) Nas duas situações, tanto o trabalho realizado quanto o calor absorvido são nulos.
A alternativa correta é letra A) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
Podemos representar as transformações do gás através do diagrama PxV a seguir:
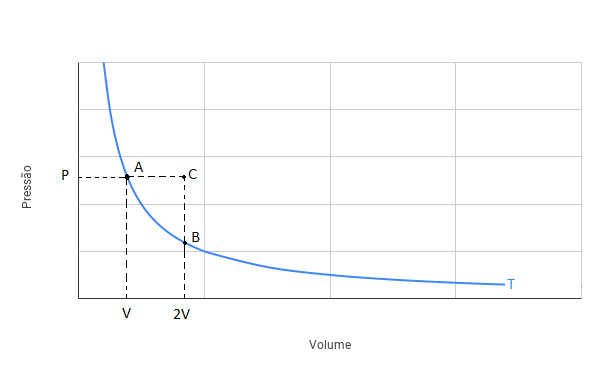
No gráfico acima, a curva em azul é uma isoterma. Assim, a transformação do gás na situação (i) vai do ponto A até o ponto B, percorrendo a curva isoterma. Na situação (ii), o gás vai do ponto A até o ponto C percorrendo uma linha horizontal (pressão constante).
Do gráfico, a área sob a curva da transformação é numericamente igual ao trabalho realizado pelo gás. Na situação (i), temos uma transformação isotérmica. Logo, podemos ilustrar o trabalho realizado no diagrama PxV mostrado na figura a seguir:
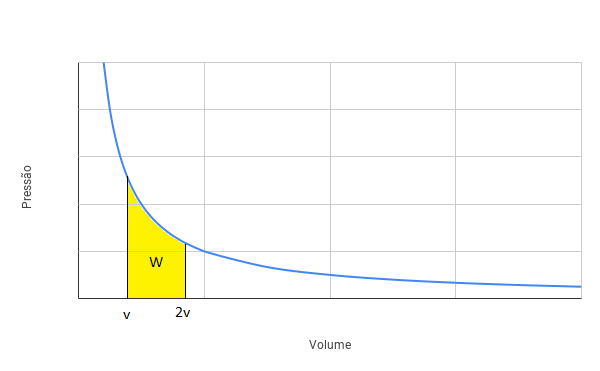
Para a situação (ii), podemos representar a transformação na figura a seguir:
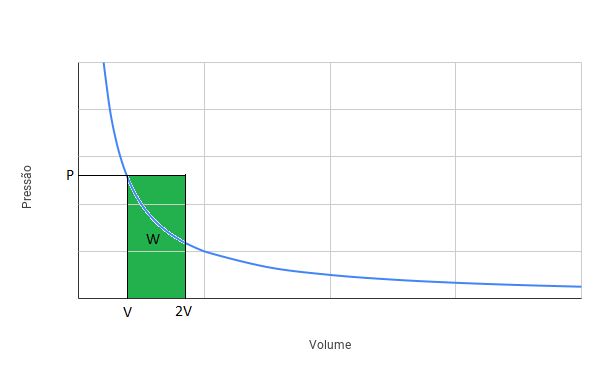
Podemos verificar que a área verde (trabalho da transformação isobárica) é maior do que a área amarela (trabalho da transformação isotérmica). Logo, o trabalho realizado na situação (i) é MENOR que o trabalho realizado na situação (ii).
De acordo com a primeira lei da termodinâmica, podemos calcular a quantidade de calor trocada através da equação:
Q = Delta U + W
Em uma transformação isotérmica, como a situação (i), a variação da energia interna é nula. Assim, temos:
Q = W
Podemos calcular o trabalho realizado em uma transformação isotérmica da seguinte forma:
W_{i} = W_{A rightarrow B} = displaystyle int_{A}^{B} p dV = displaystyle int_{A}^{B} dfrac{nRT}{V} dV =nRT displaystyle int_{A}^{B} dfrac{1}{V} dV = nRT ln dfrac{V_B}{V_A}
Logo,
W_{i} = nRT ln dfrac{2V}{V}
W_{i} = nRT ln 2
Assim, o calor transferido na situação (i) é Q_i = ln 2 cdot nRT
Na situação (ii), a pressão é constante e o trabalho pode ser calculado como:
W_{ii} = W_{A rightarrow C} = displaystyle int_{A}^{C} P dV = P displaystyle int_{A}^{C} dV = P (V_C - V_A)
W_{ii} = P( 2V - V) = PV
Ou então:
W_{ii} = nRT
A variação da energia interna de um gás monoatômico ideal é dado por:
Delta U = dfrac{3}{2} nR Delta T
Logo, o calor transferido na situação (ii) pode ser calculado da seguinte forma:
Q_{ii} = Delta U_{ii} + W_{ii}
Q_{ii} = dfrac{3}{2} nR (T_C - T) + nRT
Ainda, temos que:
dfrac{P_A V_A}{T_A} = dfrac{P_C V_C}{T_C}
dfrac{cancel P cancel V}{T} = dfrac{cancel P 2cancel V}{T_C}
T_C = 2 T
Logo
Q_{ii} = dfrac{3}{2} nR (2T - T) + nRT
Q_{ii} = dfrac{3}{2} nRT + nRT
Q_{ii} = dfrac{5}{2} nRT
Sabemos que ln 2 approx 0,69 e dfrac {5}{2} = 2,5. Então, podemos escrever,
ln 2 < dfrac{5}{2}
Como ln 2 < 1, podemos escrever:
ln 2 cdot nRT < dfrac{5}{2} cdot nRT
Q_i < Q_{ii}
Apesar da banca indicar a alternativa (A) como gabarito da questão, a resposta correta seria a alternativa (D), pois o trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii) e o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
O gabarito oficial da banca indicou a resposta (A) como correta,





