Questões Sobre Termologia - Física - concurso
241) Um engenheiro vai realizar um experimento para medir o aumento de temperatura do ar em um pneu. Assim, fez as medições antes e após percorrer certa distância em uma cidade. Inicialmente, a temperatura do ar no pneu era de 25°C a uma pressão manométrica de 200 kPa. No final do trajeto, a pressão verificada foi de 220 kPa em um local onde a pressão atmosférica é de 98 kPa. Assumindo que o volume do pneu permaneceu inalterado e que o ar se comporta como ideal, a variação da temperatura aproximada do ar no pneu, em °C, é
- A) 330
- B) 30
- C) 20
- D) -20
- E) -30
A alternativa correta é letra C) 20
Assumindo que o ar se comporta como gás ideal, temos:
dfrac {P_1 V_1}{T_1} = dfrac {P_2 V_2}{T_2}
Como o volume permaneceu inalterado, temos:
dfrac {P_1}{T_1} = dfrac {P_2}{T_2}
Logo,
T_2 = T_1 dfrac {P_2 }{P_2}
Vamos usar as unidades no SI. Assim, devemos ter a temperatura em kelvis e a pressão absoluta (manométrica + atmostférica) em Pa. Logo, temos:
T_2 = (25 + 273) cdot left( dfrac {220 cdot 10^3 +98cdot 10^3 }{200cdot 10^3 + 98cdot 10^3} right)
T_2 = (298) cdot left( dfrac {318 }{298} right)
T_2 = 318 K
T_2 = (318 - 273) ° C
T_2 = 45 ° C
A variação é dada por:
Delta theta = 45 - 25 = 20°C
Portanto, a alternativa correta é a letra (C).
242) Ar comprimido é muito usado nas indústrias para acionamento dos elementos finais de controle. Nesse âmbito, o ar escoa em um conduto com velocidade de 400 m/s, a 27°C.
- A) 452,14
- B) 379,68
- C) 241,34
- D) 120,76
- E) 87,5
A alternativa correta é letra B) 379,68
No interior do conduto, o ar desloca-se através de um escoamento compressível. Em qualquer ponto do escoamento compressível, o estado termodinâmico de um gás pode ser descrito através da relação entre a sua velocidade c, sua temperatura T, pressão P e outras propriedades termodinâmicas, como a entalpia h.
Podemos calcular a entalpia do estado de um gás através da equação:
h = C_{p0} T
Onde C_{p0} é o calor específico do gás em J/kg cdot K e T é a temperatura em kelvins.
No estudo de escoamentos, o estado de estagnação isentrópica é quando o fluido sofre uma desaceleração adiabática (sem troca de calor) reversível (pois não há variação de entropia) até a velocidade nula. Aplicando a primeira lei da termodinâmica à equação da entalpia, temos:
h_0 = h + dfrac {c^2}{2}
Onde h_0 é a entalpia de estagnação e c é a velocidade de escoamento do fluido. Como a temperatura de estagnação está associada à entalpia de estagnação, temos:
C_{p0} cdot T_0 = C_{p0} cdot T + dfrac {c^2}{2}
T_0 = dfrac {C_{p0} cdot T + dfrac {c^2}{2}} {C_{p0}}
T_0 = dfrac {1004 cdot 300 + dfrac {400^2}{2}} {1004}
T_0 = 379,68 K
Portanto, a resposta correta é a alternativa (B).
243) Para o estudo de um sistema compressível simples, as equações de Maxwell relacionam as derivadas parciais das propriedades P, s, T e v.
- A) R/T
- B) –R/T
- C) R/P
- D) –R/P
- E) 0
A alternativa correta é letra D) –R/P
Na termodinâmica, a definição de potenciais termodinâmicos e a propriedade de simetria das segundas derivadas resultam em um conjunto de equações chamado de Relações de Maxwell. Essas relações levam em consideração o tipo de energia considerada. Para a energia livre de Gibbs, essa relação tem a forma:
left({dfrac {partial S}{partial P}}right)_{T}=-left({dfrac {partial V}{partial T}}right)_{P}
Isso significa que a derivada parcial da entropia em relação à pressão, a uma temperatura constante, é igual à derivada parcial do volume em relação à temperatura, a uma pressão constante.
Dada a equação de estado
P left( V - a right) = RT
Podemos escrevê-la em função de V da seguinte forma:
left( V - a right) = dfrac {RT} {P}
V = dfrac {RT} {P} + a
Assim, a relação de Maxwell se torna:
left( dfrac { partial S}{ partial P} right)_T = - left( dfrac { partial V}{ partial T} right)_P
left( dfrac { partial S}{ partial P} right)_T = - left( dfrac { partial}{ partial T} {left( dfrac {RT} {P} + a right)} right)_P
Como a é uma constante, temos:
left( dfrac { partial S}{ partial P} right)_T = - left( dfrac { partial}{ partial T} {left( dfrac {RT} {P}right)} right)_P
Como a pressão é tomada constante, temos:
left( dfrac { partial S}{ partial P} right)_T = - dfrac {R} {P} dfrac { partial T}{ partial T}
left( dfrac { partial S}{ partial P} right)_T = - dfrac {R} {P}
Portanto, a resposta correta é a alternativa (D).
244) Um difusor de ar é parte dos componentes de um compressor centrífugo, e suas aletas têm a função de dirigir o fluxo de ar. Em um experimento no qual a temperatura do ar ambiente é de 250 K, a pressão atmosférica é igual a 60 kPa, e a temperatura de estagnação é de 500 K, considerando difusor e o coletor do compressor ambos isentrópicos, o valor aproximado da pressão de estagnação na entrada do coletor do compressor, em kPa, é
- A) 945,3
- B) 867,1
- C) 678,8
- D) 336,4
- E) 128,9
A alternativa correta é letra C) 678,8
Em qualquer ponto do escoamento compressível, o estado termodinâmico de um gás pode ser descrito através da relação entre a sua velocidade c, sua temperatura T, pressão P e outras propriedades termodinâmicas.
Podemos calcular a pressão de estagnação P_0 através da relação:
dfrac {P_0}{P} = left( dfrac {T_0}{T} right)^{ {tfrac {gamma}{ left( gamma - 1 right) }}}
Onde gamma = dfrac {C_P}{C_V} e T_0 é a temperatura de estagnação. Assim, temos:
P_0 = P cdot left( dfrac {T_0}{T} right)^{ {tfrac {gamma}{ left( gamma - 1 right) }}}
P_0 = 60 cdot left( dfrac {500}{250} right)^{ {tfrac {1,4}{ left( 1,4 - 1 right) }}}
P_0 = 60 cdot 2 ^{ 3,5 }
P_0 approx 60 cdot 11,30
P_0 approx 678
Portanto, a resposta correta é a alternativa (C).
Questão 245
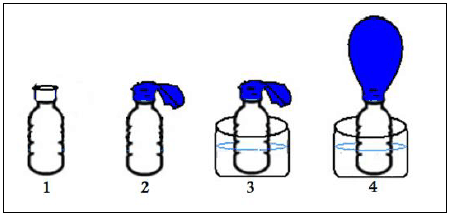
Pensando nisso, um professor aqueceu uma amostra de ar no interior de uma garrafa com um balão vazio encaixado em seu gargalo. O ar então se expandiu fazendo o balão dilatar. A seguir estão etapas do experimento:
A pressão do ar no interior da garrafa na situação final (garrafa no momento 4), em comparação à pressão atmosférica (externa), é:
- A) maior, porque o ar está em equilíbrio térmico com a sala.
- B) maior, porque o ar no interior da garrafa foi aquecido.
- C) menor, pois o ar não sofre expansão neste momento.
- D) menor, porque a água não aquece igualmente a garrafa e o balão.
- E) igual, pois o ar não sofre expansão neste momento.
A alternativa correta é letra B) maior, porque o ar no interior da garrafa foi aquecido.
De acordo com a teoria cinética dos gases, a pressão é o resultado das frequentes colisões entre as moléculas de um gás e as paredes do recipiente. O aumento da temperatura da garrafa faz com que as moléculas do vapor de água ganhem energia cinética e aumentem a pressão interna do gás no interior do balão. Assim, a pressão no interior da garrafa é maior.
Portanto, o gabarito da questão é a alternativa (B).
Questão 246
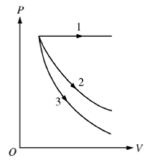
- A) 1, 2, 3.
- B) 2, 1, 3.
- C) 2, 3, 1.
- D) 3, 1, 2.
- E) 3, 2, 1.
A alternativa correta é letra D) 3, 1, 2.
Gabarito: LETRA D.
O processo isobárico consiste na transformação sob pressão constante, como nos mostra a figura a seguir:
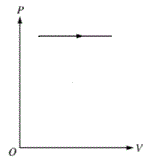
Então, podemos afirmar que o processo isobárico é identificado pela curva 1 do gráfico do enunciado.
Já um processo isotérmico é aquele em que a pressão e volume de um gás variam, porém sua temperatura é mantida constante. Para esse processo, o estado do gás é representado por uma curva sobre sua isoterma, como nos mostra a figura a seguir:
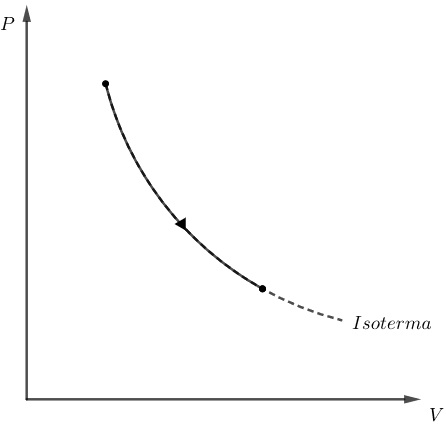
Por outro lado, um processo adiabático é uma transformação que ocorre sem troca de calor, ou seja, Q = 0. Assim, de acordo com a primeira lei da termodinâmica, temos
Delta U = Q - W
Delta U = 0 - W
Delta U = - W
Note que há uma variação negativa da energia interna do gás (diminuição da temperatura) que é equivalente (em módulo) ao trabalho realizado pelo gás. Ou seja, o estado do gás no diagrama PxV nesse processo é descrito por uma curva que liga uma isoterma a uma outra isoterma de temperatura mais baixa, como nos mostra a curva 3 na figura a seguir:
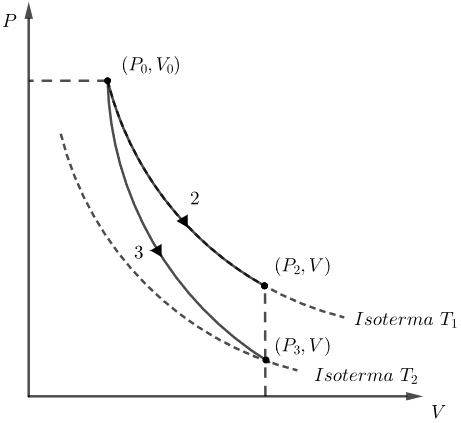
Então, podemos afirmar que o processo isotérmico é é descrito no gráfico pela curva 2 e o processo adiabático pela curva 3.
Portanto, o gabarito da questão é a alternativa (d).
Questão 247
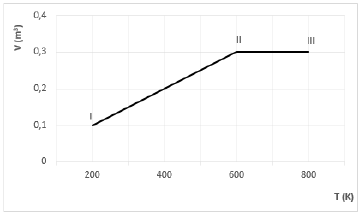
Considerando R = 2,0 cal/mol.K, qual é o trabalho realizado pelo gás nesse processo?
- A) 800 J
- B) 4 000 J
- C) 800 cal
- D) 4 000 cal
A alternativa correta é letra C) 800 cal
Sabemos que o trabalho realizado por um gás é dado por:
W = displaystyle int P dV
Como o volume é constante na transformação II rightarrow III, o trabalho é realizado pelo gás apenas na transformação I rightarrow II. De acordo com a lei geral dos gases, temos:
dfrac { P_{I} V_{I} }{ T_{I} } = dfrac { P_{II} V_{II} }{ T_{II} }
dfrac { P_{I} cdot 0,1 }{ 200 } = dfrac { P_{II} cdot 0,3}{ 600 }
P_{I} = P_{II}
Como a pressão é mantida constante, podemos encontrar o trabalho através da equação:
W = P Delta V
Sabendo a temperatura e o volume, podemos encontrar a pressão do gás utilizando a equação de estado dos gases perfeitos:
PV = nRT
Do gráfico, temos:
P_I V_I = nRT_I
P_I = dfrac {nRT_I}{V_I}
Assim, temos:
W = P Delta V
W = P_I cdot (V_{II} - V_{I})
W =dfrac {nRT_I}{V_I} cdot (V_{II} - V_{I})
W =dfrac {1,0 cdot 2,0 cdot 200}{0,1} cdot (0,3 - 0,1)
W = 800 cal
Note que usamos a constante R = 2,0 cal/mol.K, na qual a energia é dada em calorias.
Portanto, a resposta correta é a alternativa (C).
Questão 248
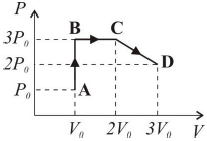
Assinale a alternativa correta.
- A) Somente as afirmativas 1 e 2 são verdadeiras.
- B) Somente as afirmativas 2 e 3 são verdadeiras.
- C) Somente as afirmativas 3 e 4 são verdadeiras.
- D) Somente as afirmativas 1, 2 e 4 são verdadeiras.
- E) As afirmativas 1, 2, 3 e 4 são verdadeiras.
A alternativa correta é letra A) Somente as afirmativas 1 e 2 são verdadeiras.
Vamos analisar cada uma das afirmativas:
O processo A→B é isométrico. CORRETA. O volume nos pontos A e B são iguais, logo o processo é chamado de isométrico.
Os pontos C e D estão à mesma temperatura. CORRETA. Podemos encontrar a relação de temperatura entre os pontos C e D através da equação geral dos gases:
dfrac {P_C V_C}{T_C} = dfrac {P_D V_D}{T_D}
Do gráfico, temos:
dfrac {3 P_0 cdot 2 V_0}{T_C} = dfrac {2 P_0 cdot 3 V_0}{T_D}
T_C = T_D
Logo, os pontos C e D estão à mesma temperatura.
O trabalho realizado pelo gás no processo B→C é nulo. INCORRETA. No processo B→C, temos uma variação de volume a pressão constante. O trabalho pode ser calculado da seguinte forma:
tau = P cdot Delta V
tau = 3 P_0 cdot (2V_0 - V_0)
tau = 3 P_0 cdot V_0
Portanto, o trabalho não é nulo.
O processo C→D é isobárico. INCORRETA. O processo C→D varia de 3 P_0 para 2 P_0. Portanto, não é isobárico.
Apenas as afirmativas 1 e 2 são verdadeiras, portanto o gabarito da questão é a alternativa (a).
249) Em um reservatório são armazenados 1 mol de gás hélio e 1 mol de gás oxigênio em equiíbrio térmico. Por meio de um orifıcio de dimensões muito menores que o comprimento livre médio das espécies gasosas, inicia-se um vazamento de gás para o exterior. Sobre essa situação são feitas as seguintes afirmações:
- A) Apenas a afirmação I é falsa.
- B) Apenas a afirmação II é falsa.
- C) Apenas a afirmação III é falsa.
- D) Há mais de uma afirmação falsa.
- E) Todas as afirmações são verdadeiras
Nota: É importante lembrar que a difusão de gases é um processo que ocorre devido ao movimento aleatório das partículas, e que as partículas mais leves (como os átomos de hélio) se movem mais rapidamente e se difundem mais facilmente.
Questão 250
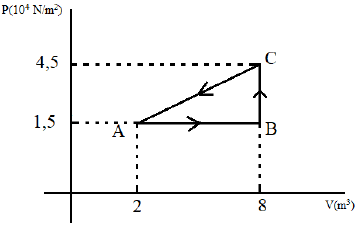
I No percurso AB, a transformação é isobárica.
II No percurso BC, o trabalho realizado pelo gás é nulo.
III No percurso BC, a transformação é isotérmica.
IV No percurso AB, o trabalho realizado pelo gás é igual a 18x10^4 J.
V Em um ciclo completo, o trabalho realizado é igual a 9x10^4J.
Está correto o que se afirma em:
- A) III e IV, somente.
- B) II e III, somente.
- C) I, II, III, IV e V.
- D) I, II e V, somente.
- E) I, II, IV e V, somente.
A alternativa correta é letra D) I, II e V, somente.
Analisamos cada um dos itens:
I No percurso AB, a transformação é isobárica. (VERDADEIRO)
Uma transformação isobárica é uma transformação a pressão constante. Notemos que a reta AB é paralela ao eixo do volume. Portanto, o trecho tem pressão contante e igual a 1,5.10^4 N/,m^2.
II No percurso BC, o trabalho realizado pelo gás é nulo. (VERDADEIRO)
O trabalho realizado por um gás é proporcional a pressão e a variação do volume. Naturalmente, o trabalho realizado por um gás depende que haja uma variação do volume - isso seria responsável por erguer um peso ou fazer girar um pistão. Como o trecho BC possui volume constante, não pode haver trabalho.
III No percurso BC, a transformação é isotérmica. (FALSO)
Isotérmica significa transformação a temperatura constante.
O trecho BC tem volume constante e aumento da pressão. Pela equação dos gases ideais, temos
frac{P.V}{T} = constante
Então a temperatura tem de aumentar para compensar o aumento da pressão a volume constante.
IV No percurso AB, o trabalho realizado pelo gás é igual a 18x10^4 J. (FALSO)
O trabalho realizado em uma transformação isobárica é o produto da pressão pela variação do volume:
W = P. Delta V
W = 1,5 .10^4 . (8-2)
W = 1,5 . 10^4 . 6
W = 9 . 10^4 J
V Em um ciclo completo, o trabalho realizado é igual a 9x10^4J. (VERDADEIRO)
Em um ciclo completo, o trabalho pode ser calculado pela área interior do ciclo:
W = frac{AB . BC}{2}
W = frac{(8-2)(4,5.10^4 - 1,5.10^4)}{2}
W = frac{6.3,0.10^4}{2}
W = 9 . 10^4 J
