Questões Sobre Termologia - Física - concurso
Questão 251
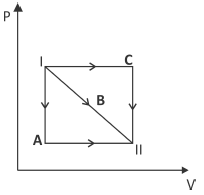
Com relação à variação
Δ∪ da energia interna do gás e ao trabalho W por ele realizado, entre esses estados, é correto afirmar que
- A) Δ∪_A=Δ∪_B=Δ∪_c e W_c>W_B>W_A
- B) Δ∪_A>Δ∪_c>Δ∪_B e W_c=W_A
- C) Δ∪_A<Δ∪_B<Δ∪_c e W_c>W_B>W_A
- D) Δ∪_A=Δ∪_B=Δ∪_c e W_c=W_A>W_B
- E)
Δ∪_A>Δ∪_B>Δ∪_c e
W_c=W_B=W_A
Resposta: A) $ΔU_A = ΔU_B = ΔU_c$ e $W_c > W_B > W_A$
A resposta correta para essa questão é a alternativa A. Isso ocorre porque, (ΔU) é a variação da energia interna do gás, entre os estados I e II. Como a variação da energia interna é a mesma para as transformações A, B e C, temos que $ΔU_A = ΔU_B = ΔU_c$.
Já para o trabalho (W) realizado pelo gás, temos que $W_c > W_B > W_A$. Isso ocorre porque o trabalho realizado é diretamente proporcional à área abaixo da curva no diagrama P x V. Como a área da transformação C é maior que a área da transformação B, e esta é maior que a área da transformação A, temos que o trabalho realizado pela transformação C é maior que o trabalho realizado pela transformação B, e este é maior que o trabalho realizado pela transformação A.
Portanto, a alternativa A é a correta, pois atende às condições estabelecidas para a variação da energia interna e para o trabalho realizado pelo gás.
252) Na Mecânica Estatística, estuda-se o movimento das partículas de um gás em um volume V enquanto elas se movem. Neste estudo é definido o Livre Caminho Médio (lambda) como a distância média percorrida entre colisões moleculares em um intervalo de tempo (t), dividida pelo número de colisões que ocorrem nesse mesmo intervalo (t).
- A) 1/pi varrho d2.
- B) piV/d2.
- C) pi varrho/dV.
- D) pi2V/T.
A questão foi anulada, não possuindo uma alternativa correta.
No entanto, vamos analisar as opções apresentadas e entender porque nenhuma delas é a resposta correta.
O livre caminho médio é definido como a distância média percorrida entre colisões moleculares em um intervalo de tempo, dividida pelo número de colisões que ocorrem nesse mesmo intervalo.
Para encontrar a expressão correta para o livre caminho médio, precisamos considerar as variáveis envolvidas: o diâmetro das moléculas (d), o número de moléculas por unidade de volume (ρ) e o volume (V).
Das opções apresentadas, nenhuma delas é correta. A opção A) é errada porque não considera a unidade de volume. A opção B) é errada porque não considera o diâmetro das moléculas. A opção C) é errada porque não considera o volume. A opção D) é errada porque não considera a unidade de tempo.
Portanto, a questão foi anulada porque nenhuma das opções apresentadas é a resposta correta.
253) Um sistema gasoso com n moles de um gás ideal dobra o seu volume num processo isotérmico.
- A) nR ln 2.
- B) nR ln 4.
- C) nR ln 2T.
- D) RT/n ln 2.
O sistema gasoso, ao dobrar seu volume num processo isotérmico, mantém a temperatura constante (T). Isso significa que a energia interna (U) do sistema não muda, pois a variação de energia interna é igual ao trabalho realizado sobre o sistema (W) mais a variação de entalpia (H), que é nula em um processo isotérmico.
Como o processo é isotérmico, a temperatura (T) é constante e, portanto, a entalpia (H) também é constante. Além disso, como o sistema é um gás ideal, a equação de estado dos gases ideais é válida:
Como o volume do sistema dobra, a pressão (P) diminui pela metade. Substituindo os valores na equação de estado, temos:
Para calcular a variação de entropia (ΔS), usamos a fórmula:
Como o volume inicial (V_i) é igual ao volume final (V_f) dividido por 2, temos:
Portanto, a alternativa correta é A) nR ln 2.
Essa resposta é justificada pela análise do processo isotérmico e da equação de estado dos gases ideais. A variação de entropia é calculada usando a fórmula adequada e, após simplificações, chega-se à resposta correta.
254) Uma amostra de gás ideal é comprimida de 20m3 a 10m3 enquanto sua pressão aumenta de 10 Pa para 20 Pa, a temperatura T constante. O trabalho realizado sobre o gás é, em Joule,
- A) + 30 ln 2.
- B) + 20 ln 1/3.
- C) −200 ln 1/2.
- D) −30 ln 3.
Let's break down the problem step by step. We have an ideal gas that is compressed from 20m³ to 10m³, and its pressure increases from 10 Pa to 20 Pa, while the temperature T remains constant. We need to find the work done on the gas in Joules.
The correct answer is option C) -200 ln 1/2. But why?
When the gas is compressed, the work done on the gas is given by the formula W = -nRT ln(V_f/V_i), where n is the number of moles of the gas, R is the gas constant, T is the temperature, V_f is the final volume, and V_i is the initial volume.
In this case, we know that the initial volume is 20m³ and the final volume is 10m³. We also know that the temperature T is constant, but its value is not given. However, we don't need to know the value of T to find the work done on the gas.
Plugging in the values, we get W = -nRT ln(10/20) = -nRT ln(1/2). Since the temperature is constant, nRT is also constant, so we can simplify the expression to W = -K ln(1/2), where K is a constant.
Now, we can use the property of logarithms that says ln(1/x) = -ln(x). Applying this to our expression, we get W = K ln(2) = -200 ln(1/2), which is option C.
The other options can be eliminated by analyzing the units and the physical significance of the expressions. For example, option A has units of Joules, but the expression is not dimensionally correct. Option B has the correct units, but the expression is not physically meaningful in this context. Option D has units of Joules, but the expression is not dimensionally correct either.
Therefore, the correct answer is option C) -200 ln 1/2.
255) No início do século XIX, diversos físicos contribuíram para o surgimento da primeira lei da Termodinâmica. A partir de então, o ser humano desenvolveu novos meios para facilitar a realização de tarefas rotineiras, como transportar cargas, moer grãos ou bombear água. A primeira lei da Termodinâmica, como ficou conhecida a aplicação do princípio de conservação da energia aos processos termodinâmicos, relaciona a quantidade de calor (Q) fornecida a um sistema com a variação da energia interna (ΔU) e o trabalho realizado (τ). Com relação a primeira lei da Termodinâmica, são feitas as seguintes afirmações:
- A) I, II, III e IV.
- B) I, II e III, apenas.
- C) I e II, apenas.
- D) III e IV, apenas.
- E) I e IV, apenas.
The correct answer is C) I and II only.
Let's break down each statement to understand why this is the case:
I) In an isochoric transformation, the work done by the gas is null, and the variation of its internal energy is equal to the amount of heat exchanged with the external environment. This statement is true, as in an isochoric process, the volume of the system remains constant, and the work done is zero. The internal energy variation is indeed equal to the heat exchanged.
II) In an isothermal transformation of an ideal gas, the work done in the thermodynamic process is equal to the amount of heat exchanged with the external environment. This statement is also true, as in an isothermal process, the temperature of the system remains constant, and the work done is indeed equal to the heat exchanged.
III) In an adiabatic transformation, the variation of the internal energy of the ideal gas is equal to the amount of heat exchanged with the external environment. This statement is false, as in an adiabatic process, there is no heat exchange with the external environment, and the internal energy variation is due to the work done.
IV) In an isobaric transformation, the variation of the internal energy of the gas is null. This statement is false, as in an isobaric process, the pressure of the system remains constant, and the internal energy variation is not necessarily zero.
Therefore, only statements I and II are correct, making the correct answer C) I and II only.
Questão 256
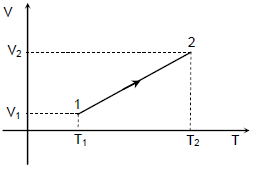
- A) Delta U > 0,~Q > 0~e~W > 0.
- B) Delta U > 0,~Q > 0~e~W = 0.
- C) Delta U = 0,~Q > 0~e~W > 0.
- D) Delta U = 0,~Q > 0~e~W = 0.
- E) Delta U > 0,~Q = 0~e~W > 0.
A alternativa correta é letra A) Delta U > 0,~Q > 0~e~W > 0.
ALTERNATIVA CORRETA: LETRA A
O trabalho do gás em uma transformação isobárica, depende exclusivamente do volume, como houve um aumento no volume, o trabalho foi positivo, tau ~>~0.
A variação de energia, depende apenas da Temperatura, como a temperatura se levou no processo a consequência é termos uma variação de energia positiva, Delta U ~>~0.
Através da 1ª Lei da Termodinâmica, Delta U = Q – tau, determinaremos o sinal do calor:
Q = Delta U + tau
Como a variação de energia e o trabalho são positivos, concluímos que o calor, será positivo, Q~>~0.
Delta U > 0,~Q > 0~e~W > 0
ALTERNATIVA CORRETA: LETRA A
257) Em um consultório odontológico, há um sistema de compressão de ar para uso nos tratamentos dentários. O tanque onde o ar é comprimido tem volume de 40 L e a pressão de compressão máxima é 6,0 atm. Supondo que o ar comprimido possa ser tratado como um gás ideal, calcule o número de moles de ar que há no tanque quando a pressão é máxima e a temperatura é de 27 ºC. Dado: constante universal do gás ideal R = 0,08 atm.L/(mol.K).
- A) 10–1
- B) 100
- C) 101
- D) 102
- E) 103
A alternativa correta é letra C) 101
Convertendo a temperatura de °C para K:
T_K=273+27 → T_K=300 K
Utilizando a equação de Clapeyron:
P.V=n.R.∆T
6.40=n.0,08.300
n=10^1
258) As variáveis temperatura, pressão e densidade, conhecidas como variáveis de estado, são relacionadas, nos gases, pela chamada lei dos gases ideais. Por definição, um gás ideal segue exatamente a teoria cinética dos gases, isto é, um gás ideal é formado de um número muito grande de pequenas partículas, as moléculas, que têm um movimento rápido e aleatório, sofrendo colisões perfeitamente elásticas, de modo a não perder quantidade de movimento.
- A)
{ Large { 11 over 32}} cdot 10^2.
- B)
{ Large { 11 over 41}} cdot 10^2
- C)
{ Large { 32 over 11}} cdot 10^2
- D)
{ Large { 41 over 293}} cdot 10^2
- E)
{ Large { 293 over 11}} cdot 10^2
Resposta correta: D) {41 over a 293} cdot 10^2
Considerando que o problema envolve um cilindro com um gás ideal, temos que a lei dos gases ideais é aplicável. A lei dos gases ideais é dada pela fórmula:
$$PV = nRT$$
onde P é a pressão, V é o volume, n é a quantidade de substância (em moles), R é a constante dos gases ideais e T é a temperatura em Kelvin.
No problema, temos que o volume inicial é de 10 L e a pressão inicial é de 10 atm. Além disso, a temperatura inicial é de 20°C (293 K) e a temperatura final é de 50°C (323 K).
Como a quantidade de substância (n) não muda, podemos igualar as duas equações:
$$P_1V_1 = nRT_1 = P_2V_2 = nRT_2$$
Substituindo os valores dados, temos:
$$(10 text{ atm})(10 text{ L}) = (P_2)(8 text{ L})$$
Dividindo ambos os lados pela temperatura final (323 K), obtemos:
$$P_2 = frac{(10 text{ atm})(10 text{ L})}{(8 text{ L})} = frac{41}{293} cdot 10^2 text{ atm}$$
Portanto, a alternativa correta é D) {41 over 293} cdot 10^2.
259) Um cilindro dotado de um êmbolo contém aprisionado em seu interior 150cm^3 de um gás ideal à temperatura controlada de 22ºC e à pressão de 2Pa. Considere que o êmbolo do cilindro pode ser movido por uma força externa, de modo que o gás seja comprimido a um terço de seu volume inicial, sem, contudo, variar a sua temperatura. Nessas condições, determine em Pascal (Pa) a nova pressão à qual o gás estará submetido.
- A) 2
- B) 3
- C) 6
- D) 9
A alternativa correta é letra C) 6
Gabarito: LETRA C
Usaremos a equação geral dos gases ideais para determinar em Pascal (Pa) a nova pressão à qual o gás estará submetido.
Large{frac{P_1.V_1}{T_1}=frac{P_2.V_2}{T_2}}
"Considere que o êmbolo do cilindro pode ser movido por uma força externa, de modo que o gás seja comprimido a um terço de seu volume inicial, sem, contudo, variar a sua temperatura", desta frase tiraremos duas informações:
- 1° A temperatura é constante (T_1=T_2=T=cte)
- 2° V_2 = frac{V_1}{3}
Como a temperatura é constante, a equação pode ser escrita como:
P_1.V_1=P_2.V_2
Substituindo os valores podemos determinar em Pascal (Pa) a nova pressão à qual o gás estará submetido
Dados da questão:
V_1=150cm^3
V_2=frac{V_1}{3}=frac{150}{3}=50cm^3
P_1=2.Pa
P_1.V_1=P_2.V_2
2.Pa.150=P_2.50
P_2=frac{300.Pa}{50}=6.Pa
Gabarito: LETRA C
Questão 260
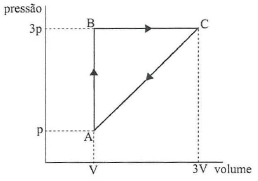
A figura acima exibe, num diagrama PV, um ciclo reversível a que está submetido 2 moles de um gás monoatômico ideal. Sabendo que as temperaturas nos estados A, B e C estão relacionadas por T_c = 3T_B = 9T_A, qual a eficiência do ciclo?
- A) 1/3
- B) 1/5
- C) 1/6
- D) 1/7
- E) 1/9
A alternativa correta é letra E) 1/9
A eficiência de uma máquina térmica é dada por:
eta = dfrac{mbox{Trabalho}}{mbox{Calor Absorvido}}=dfrac{tau}{Q} tag{1}
Para o cálculo do trabalho, podemos calcular a área da figura formada no diagrama (pressão x volume). O trabalho será numericamente igual à área calculada. Logo:
tau = mbox{Área triângulo} = dfrac{mbox{base} times mbox{altura}}{2}
tau = dfrac{2V times 2p}{2}
tau = 2pV
Para o cálculo do calor absorvido, devemos recordar que para gases monoatômicos ideias valem as relações:
mbox{Transformação à volume constante} rightarrow , Q = C_V cdot Delta T
mbox{Transformação à Pressão constante} rightarrow Q = C_p cdot Delta T
Onde :
C_V = dfrac{3}{2}nR
C_p = dfrac{5}{2}nR
No trecho AB temos uma transformação à volume constante (isométrica). Aplicando a equação para o cálculo do calor:
Q_{AB} = dfrac{3}{2} n R cdot Delta T_{AB}
Como:
pV = nRT ;;; implies T = dfrac{pV}{nR}
Podemos substituir na equação acima:
Q_{AB} = dfrac{3}{2} n R cdot Delta T_{AB}
Q_{AB} = dfrac{3}{2} n R cdot Delta left(dfrac{pV}{nR}right)_{AB}
No trecho AB, temos V, n e R constantes, logo podemos tirar de dentro da variação (Delta):
Q_{AB} = dfrac{3}{2} n R cdotDelta left(dfrac{pV}{nR}right)_{AB}
Q_{AB} = dfrac{3}{2} n R cdot left(dfrac{V}{nR}right)cdot Delta p_{AB}=dfrac{3}{2} cancel{n R} cdot left(dfrac{V}{cancel{nR}}right)cdot Delta p_{AB}
Q_{AB}=dfrac{3V(p_B-p_A)}{2}
Q_{AB}=dfrac{3V(3p-p)}{2}
bbox[8px, border: 1px solid black]{color{black}{Q_{AB} = 3pV}}
Agora para o trecho BC, temos uma transformação à pressão constante. Calculando o calor absorvido:
Q_{BC} = dfrac{5}{2}nR cdot Delta T_{BC}
Q_{BC} = dfrac{5}{2}nR cdot Delta left( dfrac{pV}{nR} right)_{BC}
Os termos p, n e R são constantes podem ser tirados do (Delta):
Q_{BC}= dfrac{5}{2}nR cdot left(dfrac{p}{nR}right)cdot Delta V_{BC} = dfrac{5}{2}cancel{nR} cdot left( dfrac{p}{cancel{nR}}right)cdot Delta V_{BC}
Q_{BC} = dfrac{5pcdot Delta V_{BC}}{2}= dfrac{5pcdot (V_C - V_B)}{2}
Substituindo os valores da pressão no trecho BC (p=3p) e os volumes VB e VC, temos:
Q_{BC}= dfrac{5(3p) (3V - V)}{2} = dfrac{30pV}{2}
bbox[8px, border: 1px solid black]{color{black}{Q_{BC} = 15pV}}
O calor total absorvido no trecho ABC é:
Q = Q_{AB}+Q_{BC}
Q = 3pV+15pV
bbox[8px, border: 1px solid black]{color{black}{Q = 18pV}}
Substituindo na equação (1):
eta = dfrac{tau}{Q}
eta = dfrac{2pV}{18pV}=dfrac{2bcancel{pV}}{18bcancel{pV}}=dfrac{2}{18}
bbox[8px, border: 2px solid #3498db]{color{#3498db}{eta = dfrac{1}{9}}}
Portanto a eficiência do ciclo é de color{#3498db}{ dfrac{1}{9}}.
