Questões Sobre Termologia - Física - concurso
Questão 261
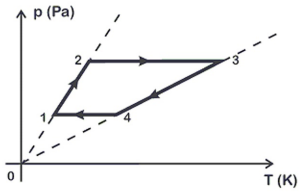
De posse dessas informações e analisando o gráfico, o pesquisador concluiu que o trabalho e a variação da energia interna neste ciclo foram de:
- A) - 1500 J e zero.
- B) Zero e +1500 J.
- C) +1500 J e zero.
- D) Zero e zero.
- E) Zero e - 1500 J.
A alternativa correta é letra C) +1500 J e zero.
O trabalho realizado por um gás ideal no ciclo mostrado na figura é dado por:
W=Delta{P}cdotDelta{V}tag 1
Do ciclo 1 até ao 4 e retornar ao 1, temos:
Delta{P}=700-200=500Pa
Delta{V}=V_4-V_1=3,5-0,5=3m^3
W=500cdot3=1500,J
A energia interna de um gás é proporcional a sua temperatura interna. Como não há variação de temperatura ao longo do ciclo, logo a variação de temperatura interna ao se completar o ciclo é zero.
Gabarito: C
262) Certa quantidade de gás ideal ocupa um volume V0 quando sua temperatura é T0 e sua pressão é P0. Expande-se o gás, isotermicamente, até duplicar o seu volume. A seguir, mantendo o seu volume constante sua pressão é restabelecida ao valor original P0. Podemos afirmar que a temperatura final do gás neste último estado de equilibro é:
- A) T0/4
- B) T0/2
- C) T0
- D) 2T0
- E) 4T0
A alternativa correta é letra D) 2T0
ALTERNATIVA CORRETA: LETRA D
frac{P_0.V_0}{T_0}=frac{P.V}{T}
V=2.V_0
P=P_0
frac{cancel{P_0}.cancel{V_0}}{T_0}=frac{cancel{P_0}.2.cancel{V_0}}{T}
T=2.T_0
ALTERNATIVA CORRETA: LETRA D
Questão 263
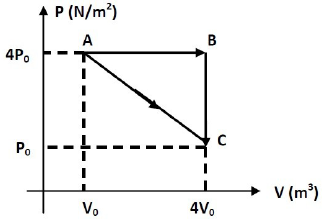
- A) A temperatura do gás no estado A é maior que a temperatura no estado B.
- B) A transformação do gás do estado A para o estado C é isotérmica.
- C) O gás se expande isotermicamente do estado A para o estado B.
- D) A pressão do gás no estado B é menor que a pressão no estado C.
- E) O gás diminui de volume quando passa do estado B para o estado C.
A alternativa correta é letra B) A transformação do gás do estado A para o estado C é isotérmica.
ALTERNATIVA CORRETA: LETRA B
a) A temperatura do gás no estado A é maior que a temperatura no estado B.
ERRADA
frac{P_A.V_A}{T_A}=frac{P_B.V_B}{T_B}
frac{4.P_0.V_0}{T_A}=frac{4.P_0.4.V_0}{T_B}
T_B=4.T_A
b) A transformação do gás do estado A para o estado C é isotérmica.
CORRETA
frac{P_A.V_A}{T_A}=frac{P_C.V_C}{T_C}
frac{4.P_0.V_0}{T_A}=frac{P_0.4.V_0}{T_C}
T_A=T_C
c) O gás se expande isotermicamente do estado A para o estado B.
ERRADA
frac{P_A.V_A}{T_A}=frac{P_B.V_B}{T_B}
frac{4.P_0.V_0}{T_A}=frac{4.P_0.4.V_0}{T_B}
T_B=4.T_A
d) A pressão do gás no estado B é menor que a pressão no estado C.
ERRADA
P_B=4.P_0
P_C=P_0
P_B~>~P_C
e) O gás diminui de volume quando passa do estado B para o estado C.
ERRADA
V_A=4.V_0
V_C=V_0
V_A~>~V_C
ALTERNATIVA CORRETA: LETRA B
Questão 264
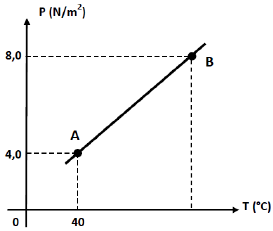
É correto afirmar que no estado B, a temperatura do gás é igual a:
- A) 273 K
- B) 513 K
- C) 353 K
- D) 253 K
- E) 595 K
A alternativa correta é letra C) 353 K
ALTERNATIVA CORRETA: LETRA C
Usaremos a lei de Lei de Charles e Gay-Lussac:
frac{P}{T}=cte
frac{P_A}{T_A}=frac{P_B}{T_B}
frac{4}{40}=frac{8}{T_B}
T_B=80°C = 80 +273 = 350K
Questão 265
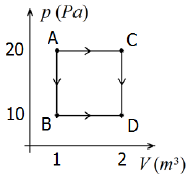
Com base nas informações contidas na figura, podemos afirmar que:
- A) TC > TA = TD > TB
- B) TC > TA > TD > TB
- C) TC > TD > TA > TB
- D) TA > TC > TB > TD
- E) TB > TA = TD > TD
Let's analyze the diagram and the given information to determine the correct answer.
The diagram shows a process where a certain amount of ideal gas goes from state A to state D through the indicated processes. We need to find the correct relationship between the temperatures TA, on the diagram.
From the diagram, we can see that the process from A to D involves an isothermal expansion from A to C, followed by an isochoric process from C to D. Since the temperature remains constant during the isothermal expansion, we can conclude that TA = TC.
Now, let's examine the given options:
- A) TC > TA = TD > TB
- B) TC > TA > TD > TB
- C) TC = TD > TA > TB
- D) TA > TC > TD > TB
- E) TB > TA = TD > TC
From our previous analysis, we know that TA = TC. Therefore, option A) TC > TA = TD > TB is the correct answer.
The correct answer is A) TC > TA = TD > TB.
This answer makes sense because the temperature remains constant during the isothermal expansion from A to C, and then decreases during the isochoric process from C to D.
Questão 266
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas.
As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com.
Admita que, imediatamente após a colocação do gás argônio em uma embalagem específica, esse gás assume o comportamento de um gás ideal e apresenta as seguintes características:
Pressão = 1 atm
Temperatura = 300 K
Massa = 0,16 g
Nessas condições, o volume, em mililitros, ocupado pelo gás na embalagem é:
- A) 96
- B) 85
- C) 77
- D) 64
A alternativa correta é letra A) 96
Pela lei dos gases ideais, lembremos que:
Pcdot V = ncdot Rcdot T tag 1
Qual é o número de mols n do gás argônio utilizado na embalagem? Devemos consultar na tabela periódica para saber quantos gramas desse gás há em 1 mol. Verificaremos que 40g equivalem a 1 mol. Então, determinemos quantos mols haverá em 0,16g:
40g longrightarrow 1, mol
0,16g longrightarrow n
n = frac{1cdot 0,16}{40}
boxed{n = 0,004 ,mol}
Vamos agora usar esses valores na Eq.(1):
1cdot V = 0,004cdot 0,08cdot 300
Obs: O valor da constante universal dos gases é 0,08.
V = 0,096, litros
ou
V = 96, mililitros
Analisando todas as alternativas, concluímos que o nosso gabarito é a letra A.
Gabarito: A
267) Uma lâmpada incandescente consiste de um filamento no vácuo. Em condições normais de funcionamento o filamento tem uma temperatura de 1600 K. Outra lâmpada com um filamento similar, que está em um bulbo preenchido com gás, tem o filamento com temperatura de 3200 K. Considere que ambos os filamentos, neste processo, se comportam como corpos negros. Analisando-se os espectros das radiações emitidas pelo filamento no vácuo e pelo filamento no ar, respectivamente, verifica-se que a razão entre os comprimentos de onda nos quais as intensidades das radiações são máximas é de
- A) 1:2.
- B) 1:1.
- C) 2:1.
- D) 8:1.
- E) 16:1.
Resposta: A alternativa correta é C) 2:1.
Para entender porque essa é a resposta correta, precisamos analisar o comportamento dos filamentos como corpos negros. De acordo com a lei de Wien, a temperatura de um corpo negro é inversamente proporcional ao comprimento de onda da radiação emitida. Matematicamente, isso pode ser representado como:
$$lambda_m T = b$$Onde $lambda_m$ é o comprimento de onda da radiação emitida, $T$ é a temperatura do corpo negro e $b$ é a constante de Wien.
No caso da lâmpada incandescente no vácuo, a temperatura do filamento é de 1600 K. Já no caso da lâmpada com o filamento no bulbo preenchido com gás, a temperatura do filamento é de 3200 K. Como os filamentos se comportam como corpos negros, podemos aplicar a lei de Wien para encontrar a razão entre os comprimentos de onda das radiações emitidas.
Dividindo as duas equações, obtemos:
$$frac{lambda_{m1}}{lambda_{m2}} = frac{T_2}{T_1}$$Substituindo os valores, temos:
$$frac{lambda_{m1}}{lambda_{m2}} = frac{3200 K}{1600 K} = 2$$Portanto, a razão entre os comprimentos de onda das radiações emitidas é de 2:1, o que corresponde à alternativa C.
268) Um recipiente adiabático de volume V é dividido em dois volumes iguais V1 e V2. Inicialmente, um gás ideal é confinado no volume V1. O volume V2 é evacuado. A partição que separa os dois volumes é então removida e o gás que estava no volume V1 passa a ocupar os dois volumes V=V1 + V2. Se a temperatura inicial do gás era T0, podemos afirmar que
- A) a energia interna total E não muda e a temperatura final Tf diminui (Tf < T0).
- B) a temperatura final não muda Tf = T0 e a energia interna E diminui.
- C) a temperatura final diminui Tf < T0 e a energia interna E diminui.
- D) a temperatura final não muda Tf = T0 e a energia interna E é a mesma.
- E) a temperatura final passa a ser a metade Tf = T0/2 e a energia interna E diminui.
A alternativa correta é a letra D) a temperatura final não muda Tf = T0 e a energia interna E é a mesma.
Para entender por que essa é a resposta certa,, alternativa D, vamos analisar o que acontece no sistema.
Inicialmente, o gás ideal está confinado no volume V1 e o volume V2 está evacuado. Quando a partição que separa os dois volumes é removida, o gás se expande e ocupa os dois volumes, V = V1 + V2.
Essa expansão é adiabática, pois não há transferência de calor entre o sistema e o meio exterior. Além disso, como o gás é ideal, não há variação na energia interna do sistema.
Portanto, a temperatura final Tf não muda em relação à temperatura inicial T0, pois a energia interna do sistema não varia. Isso é uma característica dos processos adiabáticos, onde a temperatura permanece constante.
Além disso, como a energia interna do sistema não varia, a alternativa D é a única que apresenta essa característica.
As outras alternativas apresentam mudanças na energia interna ou na temperatura, o que não é compatível com o processo adiabático descrito no enunciado da questão.
269) Um gás ideal tem seu estado termodinâmico completamente determinado pelas variáveis
- A) pressão, volume e carga elétrica.
- B) pressão, volume e temperatura.
- C) pressão, carga elétrica e temperatura.
- D) densidade, volume e gravidade.
A alternativa correta é letra B) pressão, volume e temperatura.
A primeira lei da termodinâmica é dada por:
Delta U = W - Q = p times V - Q
O calor dado por Q pode ser traduzido em fórmulas distintas a depender de cada caso. Porém, para ter transferência de calor, via de regra, tem que ter um diferencial de temperatura (lembrar que calor equivale a energia em fluxo. Para ter fluxo, precisa-se ter diferença de temperatura).
Gabarito: LETRA B.
270) Um gás ideal, em um recipiente, é mantido em temperatura constante e em equilíbrio térmico com a vizinhança. Nesse gás, o produto da pressão pelo volume é
- A) constante, independente de troca de massa com a vizinhança.
- B) constante, desde que a razão entre temperatura e número de moles seja constante.
- C) indefinido, pois o número de moles do gás só depende da temperatura.
- D) constante, desde que não haja entrada ou saída de gás.
A alternativa correta é letra D) constante, desde que não haja entrada ou saída de gás.
No caso em tela, o sistema permanecerá com o produto da pressão pelo volume (relação de trabalho) constante contanto que não haja alteração de temperatura, pressurização por força externa e nem injeção/extração de massa do sistema.
a) constante, independente de troca de massa com a vizinhança.
ERRADO. Se alterar a massa, altera-se a pressão (mais/menos volume de gás dentro do sistema).
b) constante, desde que a razão entre temperatura e número de moles seja constante.
ERRADO. Pode-se alterar a temperatura e os moles de forma que a razão seja constante, e isso variar a relação pressão e volume.
c) indefinido, pois o número de moles do gás só depende da temperatura.
ERRADO. alternativa "viajou". O número do moles de gás não tem relação direta com a temperatura (pode-se variar um ou outro sem relação direta).
d) constante, desde que não haja entrada ou saída de gás.
CORRETO. Visto que está com temperatura constante e a questão não mencionou aumento ou diminuição da pressão exercida, se não tivermos a entrada ou saída de gás a pressão e o volume permanecerão constante.
Gabarito: Letra D.
