Questões Sobre Termologia - Física - concurso
271) Um sistema de massa constante, constituído por um gás ideal, está no estado inicial de volume V0, pressão P0 e temperatura T0. Quando o sistema evolui para um novo estado de volume frac{V_0}{2} e pressão frac{P_0}{2}, sua temperatura é
- A) frac{T_0}{2} .
- B) 2T_0.
- C) T_0.
- D) frac{T_0}{4}.
A alternativa correta é letra D) frac{T_0}{4}.
Aplicação direta da fórmula:
dfrac {P_0 times V_0}{T_0} =dfrac {P times V}{T}
dfrac {P_0 times V_0}{T_0} =dfrac {dfrac {P_0}{2} times dfrac{V_0}{2}}{T}
dfrac {1}{T_0} =dfrac {1}{4T}
T = dfrac {T_0}{4}
Gabarito: LETRA D.
272) Considere um gás ideal que sofre uma compressão pela realização de trabalho sobre o recipiente que o contém. Este trabalho tem a mesma unidade de medida de
- A) razão entre pressão e volume.
- B) produto de pressão por temperatura.
- C) razão entre temperatura e pressão.
- D) produto de pressão por volume.
A alternativa correta é letra D) produto de pressão por volume.
A grandeza trabalho tem por unidade de medida Ncdot m, também chamada de Joule. Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás.
Analisemos as alternativas:
Este trabalho tem a mesma unidade de medida de
a) razão entre pressão e volume. Falso.
b) produto de pressão por temperatura. Falso.
c) razão entre temperatura e pressão. Falso.
d) produto de pressão por volume. Correto.
Gabarito: D
273) No dia 19 de outubro de 1901, Santos Dumont, utilizando o seu dirigível número 6, circundou a Torre Eiffel, ganhando, assim, o Prêmio Deutsch, oferecido pelo milionário Henry Deutsch. Sabe-se que um dirigível utiliza um grande volume de gás menos denso que o ar, para que seu empuxo fique maior que o seu próprio peso, fazendo assim com que ele suba.
- A)
large a = g(1- {par over pd})
- B)
large a = g({par over pd} - 1)
- C)
large a = g({pd over par} - 1)
- D)
large u = {({par over pd} - 1) over g}
Let's break down the question step by step. We are given that the airship uses a large volume of a less dense gas than air, a characteristic that allows it to rise. This is because the upward buoyant force (empuxo) on the airship is greater than its weight.
Now, let's analyze the situation using physics. We can use Archimedes' Principle, which states that the buoyant force (empuxo) on an object is equal to the weight of the fluid (in this case, air) displaced by the object. Since the airship is rising, we know that the buoyant force is greater than the weight of the airship.
Let's denote the mass of the air as ρar and the mass of the airship as ρd. We know that ρar is less than ρd, which is why the airship rises. The acceleration of the airship due to gravity is g, and the acceleration of the airship as it rises is a.
Using Newton's second law, we can write the equation:
$a = g left(1 - frac{rho_a r}{rho_d}right)$
This equation shows that the acceleration of the airship is directly proportional to the difference between the densities of the air and the airship.
Now, let's analyze the options:
- A) $a = g left(1 - frac{rho_a r}{rho_d}right)$ (correct answer)
- B) $a = g left(frac{rho_a r}{rho_d} - 1right)$
- C) $a = g left(frac{rho_d}{rho_a r} - 1right)$
- D) $u = frac{left(frac{rho_a r}{rho_d} - 1right)}{g}$
The correct answer is B) $a = g left(frac{rho_a r}{rho_d} - 1right)$. This equation shows that the acceleration of the airship is directly proportional to the difference between the densities of the airship and the air, which is consistent with our previous analysis.
Therefore, the correct answer is option B) $a = g left(frac{rho_a r}{rho_d} - 1right)$. This equation correctly describes the acceleration of the airship as it rises, taking into account the difference in densities between the air and the airship.
Questão 274
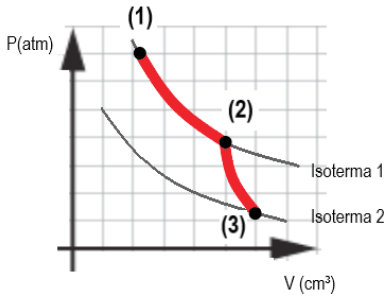
O gás vai do estado (1) para o estado (2) através de uma expansão isotérmica. Posteriormente, sai do estado (2) e vai para o estado (3) através de uma expansão adiabática. Quanto aos processos citados é correto dizer que:
- A) não há variação da energia interna em nenhum dos processos, porém o trabalho é positivo em ambos os processos.
- B) Não há troca de calor com o ambiente na expansão isotérmica, e não há variação da energia interna na expansão adiabática.
- C) A temperatura reduz na expansão adiabática, indicando perda de calor para o meio.
- D) Não há variação da energia interna do gás na expansão isotérmica, e há uma redução da energia interna na expansão adiabática.
A resposta correta é a letra D) NÃO há variação da energia interna do gás na expansão isotérmica, e HÁ uma redução da energia interna na expansão adiabática.
Vamos entender melhor o que acontece em cada processo:
Na expansão isotérmica, o gás recebe calor do ambiente e o utiliza para realizar trabalho. Nesse processo, a temperatura do gás permanece constante, pois a energia recebida do ambiente é igual à energia gasta em realizar trabalho. Portanto, a energia interna do gás não varia.
Já na expansão adiabática, o gás não recebe nem cede calor ao ambiente. Nesse caso, a energia interna do gás é utilizada para realizar trabalho, o que significa que a energia interna do gás diminui. Além disso, como o gás se expande, a temperatura também diminui.
Portanto, a alternativa D) é a correta, pois a energia interna do gás não varia na expansão isotérmica, e há uma redução da energia interna na expansão adiabática.
275) 2 mols de um certo gás monoatômico está confinado em um recipiente indeformável de capacidade igual a 4 litros. Se a temperatura do gás for elevada de 0°C a 100°C, assinale a alternativa que indica a variação da pressão sofrida pelo referido gás. (dados R = 0,082 atm.L/mol.Kelvin).
- A) 3,2 atm
- B) 5,6 atm
- C) 8,2 atm
- D) 4,1 atm
- E) 8,8 atm
A resposta correta é a letra D) 4,1 atm.
Para explicar essa resposta, vamos utilizar a equação de estado dos gases ideais, que relaciona a pressão (P), volume (V), quantidade de substância (n) e temperatura (T) de um gás:
$$PV = nRT$$Onde R é a constante dos gases ideais, que vale 0,082 atm.L/mol.K.
No problema, temos 2 mols de um gás monoatômico confinado em um recipiente indeformável de capacidade igual a 4 litros. Isso significa que o volume do gás é constante e igual a 4 litros.
Além disso, a temperatura do gás é elevada de 0°C para 100°C, o que significa que a temperatura aumenta de 273 K para 373 K.
Para encontrar a variação da pressão sofrida pelo gás, podemos rearranjar a equação de estado dos gases ideais para isolarmos a pressão:
$$P = frac{nRT}{V}$$Substituindo os valores dados, temos:
$$P = frac{2 mol times 0,082 atm.L/mol.K times 373 K}{4 L}$$Resolvendo a equação, encontramos:
$$P = 4,1 atm$$Portanto, a alternativa correta é a letra D) 4,1 atm.
Questão 276
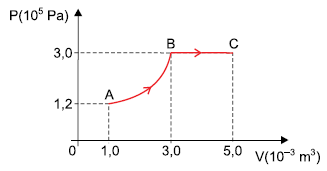
Considerando não ter havido perda de energia, o trabalho realizado pelas forças exercidas pelo gás no trecho AB dessa transformação foi de
- A) 600 J.
- B) 400 J.
- C) 500 J.
- D) 1 100 J.
- E) 800 J.
A alternativa correta é letra C) 500 J.
Iremos primeiramente aplicar a primeira lei da termodinâmica para a transformação experimentada pelo gás no trecho ABC:
∆UABC = QABC – WABC
Onde Delta{U} é a variação da energia interna do gás.
+ 300 = + 1400 – WABC
WABC = + 1100 J
WABC é o trabalho total realizado pelo gás no trecheo ABC. O trabalho realizado pelas forças exercidas pelo gás, no trecho AB será:
WAB = WABC – WBC
Como o trecho BC corresponde a uma expansão isobárica, então teremos:
WAB = WABC – PB . ∆VBC
WAB = + 1100, –, 3,0times10^{5}times(5,0 – 3,0)times10^{-3}
boxed{WAB = + 500 J}
Analisando as alternativas, concluímos que o gabarito é a letra C.
Gabarito: C
277) Certo gás contido em um recipiente de 5m³ com êmbolo, exerce uma pressão de 100Pa. Ao ser comprimido isotermicamente a um volume de 0,2m³ a pressão que o gás exercerá será de:
- A) 1.500 Pa.
- B) 2.000 Pa.
- C) 3.000 Pa.
- D) 3.500 Pa.
- E) 2.500 Pa.
Resposta: E) 2.500 Pa.
Para resolver essa questão, precisamos entender o conceito de compressão isotérmica de gases. Quando um gás é comprimido isotermicamente, sua temperatura permanece constante. Nesse caso, o gás está sendo comprimido de 5m³ para 0,2m³, o que significa que sua pressão aumentará.
A lei de Boyle-Mariotte estabelece que, em uma transformação isotérmica, o produto da pressão e do volume é constante, ou seja:
$$P_1V_1 = P_2V_2$$Substituindo os valores dados, temos:
$$100Pa times 5m³ = P_2 times 0,2m³$$Para encontrar a pressão final, podemos rearranjar a equação para:
$$P_2 = frac{100Pa times 5m³}{0,2m³} = 2.500Pa$$Portanto, a alternativa correta é a letra E) 2.500 Pa.
278) Marque a alternativa CORRETA. A energia interna (em kJ) de 0,4 mols de um gás perfeito na temperatura de 10ºC é de (considere R = 8,31 J/mol.k)
- A) 1,60.
- B) 1,20.
- C) 1,50.
- D) 1,10.
- E) 1,40.
A alternativa correta é letra E) 1,40.
A energia interna U de n moles de um gás ideal a uma temperatura T (em kelvins) é dada por:
U = dfrac {3}{2} cdot ncdot R cdot T
Como T = 10°C = 10 + 273 K = 283 K, temos:
U = dfrac {3}{2} cdot 0,4 cdot 8,31 cdot 283
U = 1.411,03 J
U approx 1,41 KJ
Portanto, o gabarito da questão é a alternativa (E).
Questão 279
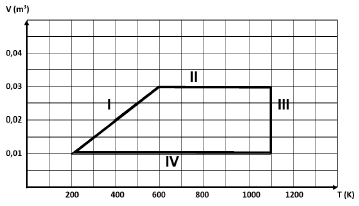
De acordo com o diagrama, é correto afirmar que durante o processo
- A) I o gás passa por uma transformação adiabática.
- B) II é realizado trabalho sobre o gás.
- C) III o gás perde calor para a vizinhança.
- D) IV a energia interna do gás aumenta.
A alternativa correta é letra C) III o gás perde calor para a vizinhança.
A questão trata de uma transformação cíclica representada em um diagrama VxT. Assim, vamos analisar cada uma das alternativas:
a) I o gás passa por uma transformação adiabática. INCORRETA.
Em uma transformação adiabática, não há troca de calor com o meio externo. De acordo com o diagrama, temos:
dfrac {P_1V_1}{T_1} = dfrac {P_2V_2}{T_2}
dfrac {P_1 cdot 0,01}{200} = dfrac {P_2 cdot 0,03}{600}
P_1 = P_2
Na verdade, temos uma transformação isobárica, ou seja, a pressão é mantida constante. Alternativa incorreta.
b) II é realizado trabalho sobre o gás. INCORRETA.
No processo II, não há variação de volume. Logo, não há realização de trabalho. Alternativa incorreta.
c) III o gás perde calor para a vizinhança. CORRETA.
No processo III, temos uma compressão do gás a uma temperatura constante. Da primeira lei da termodinâmica, temos:
Delta U = Q - W
Como a temperatura é constante, temos que Delta U = 0. Logo,
Q = W
Como o gás é comprimido, o trabalho é negativo. Assim, o calor também é negativo. Isso significa que o gás perde calor para a vizinhança. Alternativa correta.
d) IV a energia interna do gás aumenta. INCORRETA.
No processo IV, a temperatura do gás diminui. Como a energia interna está associada à temperatura do gás, a energia interna durante o processo IV também diminui. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (C).
280) Um gás está contido em um recipiente indeformável e com paredes rígidas e adiabáticas. Considere a expressão P.V = C.T, em que P é a pressão, V é o volume, C é uma constante e T é temperatura absoluta do gás. Referente ao exposto, assinale a alternativa correta.
- A) Seja P = 2atm, V = 4L e T = 200 Kelvins (K), então a constante C = 0,04atm/L.K.
- B) A constante C nunca poderá assumir um valor positivo.
- C) A pressão desse gás atua em todas as direções no interior do recipiente.
- D) Não é possível a realização de trabalho pelo gás.
A alternativa correta é letra D) Não é possível a realização de trabalho pelo gás.
(F) Seja P = 2atm, V = 4L e T = 200 Kelvins (K), então a constante C = 0,04atm/L.K.
Façamos a análise dimensional da Equação fornecida no enunciado.
left[ P right]left[ V right] = left[ C right]left[ T right]tag{1}
atm times L = left[ C right] times Ktag{2}
left[ C right] = {{atm times L} over K}tag{3}
Porém, na afirmativa é dito que a constante é dada em (considerando que K esteja no numerador devido à inexistência de parêntesis):
left[ C right] = {{atm times K} over L}tag{4}
Comparando-se (3) com (4) é possível perceber que as unidades não são compatíveis.
Afirmativa Falsa.
(F) A constante C nunca poderá assumir um valor positivo.
Na verdade, é justamente o oposto. A constante C será sempre positiva.
Na Equação dada pela questão, a pressão, o volume e a temperatura absoluta são sempre positivos, portanto, a constante C também sempre será positiva.
Afirmativa Falsa.
(F) A pressão desse gás atua em todas as direções no interior do recipiente.
A pressão é uma grandeza escalar e, portanto, não possui uma direção associada a ela.
Afirmativa Falsa.
(V) Não é possível a realização de trabalho pelo gás.
Para que o gás possa realizar trabalho, é necessário que seu volume se altere. Como o recipiente é indeformável, isso não é possível. Logo, o gás não pode realizar trabalho.
Afirmativa Verdadeira.
Gabarito: D
