Questões Sobre Termologia - Física - concurso
Questão 281

O valor da razão entre as temperaturas absolutas T2/T1 corresponde a:
- A) 3/5.
- B) 5/3.
- C) 8/5.
- D) 11/13.
- E) 13/11.
A alternativa correta é letra B) 5/3.
De acordo com a lei dos gases ideais, temos que:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Logo,
dfrac { T_2 } { T_1 } = dfrac { P_2 V_2 } { P_1 V_1 }
Do gráfico, temos que P_1 = P_2 = 8 , N/m^2, V_1 = 3 , m^3 e V_2 = 5 , m^3. Então, temos que:
dfrac { T_2 } { T_1 } = dfrac { cancel 8 cdot 5 } { cancel 8 cdot 3 }
dfrac { T_2 } { T_1 } = dfrac 5 3
Portanto, a resposta correta é a alternativa (B).
282) “Um gás ideal cuja temperatura é 270°C está encerrado em um recipiente de 12 L a uma pressão de 1,6 atm. Após uma compressão isotérmica, o volume do gás passou para 80% de seu valor inicial e sua nova pressão ficou que a pressão inicial.” Assinale a alternativa que completa corretamente a afirmativa anterior.
- A) 20% maior
- B) 25% maior
- C) 20% menor
- D) 25% menor
A alternativa correta é letra B) 25% maior
Gabarito: B
“Um gás ideal cuja temperatura é 270°C está encerrado em um recipiente de 12 L a uma pressão de 1,6 atm. Após uma compressão isotérmica, o volume do gás passou para 80% de seu valor inicial e sua nova pressão ficou que a pressão inicial.” Assinale a alternativa que completa corretamente a afirmativa anterior.
Resolução:
De acordo com a lei geral dos gases ideais, podemos escrever a seguinte relação entre as grandezas dos estados inicial e final do gás:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Como a compressão é isotérmica, temos que T_2 = T_1, ou seja:
dfrac { P_1 V_1 } { cancel { T_1 } }= dfrac { P_2 V_2 } { cancel { T_1 } }
P_1 V_1 = P_2 V_2
Assim, a nova pressão do gás é dada por:
P_2 = dfrac { V_1 }{ V_2 } P_1
De acordo com o enunciado, o volume do gás passou para 80% de seu valor inicial, ou seja, V_2 = 0,8 V_1. Assim, temos que:
P_2 = dfrac { cancel { V_1 } }{ 0,8 cancel { V_1 } } P_1
P_2 = 1,25 P_1
P_2 = P_1 + 0,25 P_1
P_2 = P_1 + 25%P_1
Portanto, a resposta correta é a alternativa (b) 25% maior.
283) O volume máximo de ar que o pulmão de um indivíduo adolescente pode receber em uma inspiração forçada é 4,0 L. Supondo que o ar pode ser considerado como um gás ideal e que, quando inspiramos, a pressão máxima interna no pulmão é aproximadamente igual à pressão atmosférica à temperatura de 27 oC, calcule o número máximo de moles de ar que inspiramos por vez em uma inspiração forçada. Dados: para efeito de cálculo, considere a pressão atmosférica 1,0 atm = 105 Pa = 105 N/m2 e a constante dos gases ideais R = 8,0 J/(mol-K); 1 L = 10−3 m3.
- A) 1
- B) 1/2
- C) 1/4
- D) 1/6
- E) 1/8
A alternativa correta é letra D) 1/6
Gabarito: D
O volume máximo de ar que o pulmão de um indivíduo adolescente pode receber em uma inspiração forçada é 4,0 L. Supondo que o ar pode ser considerado como um gás ideal e que, quando inspiramos, a pressão máxima interna no pulmão é aproximadamente igual à pressão atmosférica à temperatura de 27 oC, calcule o número máximo de moles de ar que inspiramos por vez em uma inspiração forçada. Dados: para efeito de cálculo, considere a pressão atmosférica 1,0 atm = 105 Pa = 105 N/m2 e a constante dos gases ideais R = 8,0 J/(mol-K); 1 L = 10−3 m3.
Resolução:
Para resolver essa questão, devemos lembrar da equação de Clapeyron, que estabelece uma relação entre as variáveis de estado P, V, T e n através da seguinte expressão:
PV = nRT
Assim, substituindo-se os valores do enunciado (no SI),
begin{cases} P = 1,0 , atm = 1,0 times 10^5 , Pa \ \ V = 4,0 , l = 4,0 times 10^{-3} , m^3 \ \ T = 27° = 300 , Kend{cases}
Temos que:
1,0 times 10^5 cdot 4,0 times 10^{-3} = n cdot 8 cdot 300
400 = 2400 n
n = dfrac { 400 } { 2400 }
n = dfrac 16
Portanto, a resposta correta é a alternativa (d) 1/6.
Questão 284
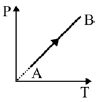
Entre as alternativas, assinale aquela que melhor representa o gráfico P em função de V (volume) correspondente a transformação termodinâmica de A para B.
- A)
- B)
- C)
- D)
A alternativa correta é letra C)
Gabarito: C
Resolução:
Observando o gráfico do enunciado que mostra a pressão em função da temperatura, podemos constatar que esse gás ideal sofreu um aumento na pressão e na temperatura. Dessa maneira, o gráfico da pressão P em função do volume V dessa transformação deverá apresentar um aumento de P. Com isso, podemos excluir a alternativa (b), que mostra uma transformação a pressão constante, e a alternativa (d), que mostra uma transformação na qual a pressão P diminui.
Entretanto, devemos lembrar da equação geral dos gases ideias, que é dada por:
PV=nRT
Analisando a equação acima, podemos perceber que, para que a temperatura e a pressão aumentem, o volume deve permanecer constante para que a equação seja válida. Nesse caso, a resposta correta é a alternativa (C), que nos mostra uma transformação na qual a pressão aumenta e o volume se mantém constante.
Portanto, a resposta correta é a alternativa (C).
285) É comum, na Termodinâmica, utilizar a seguinte expressão: (P 1V 1)/T 1 é igual a (P 2V 2)/T 2. Nessa expressão, P, V e T representam, respectivamente, a pressão, o volume e a temperatura de uma amostra de um gás ideal. Os números representam os estados inicial (1) e final (2). Para utilizar corretamente essa expressão é necessário que o número de mols, ou de partículas, do estado final seja _________ do estado inicial e que a composição dessa amostra seja _________ nos estados final e inicial.
- A) o mesmo – a mesma
- B) diferente – a mesma
- C) o mesmo – diferente
- D) diferente – diferente
A alternativa correta é letra A) o mesmo – a mesma
Para utilizar corretamente essa expressão é necessário que o número de mols, ou de partículas, do estado final seja o mesmo do estado inicial e que a composição dessa amostra seja a mesma nos estados final e inicial.
A equação de Clapeyron relaciona as três variáveis de estado dos gases (pressão (P), volume (V) e temperatura (T)) para uma composição de amostra e quantidade “n” de mols de partículas de um gás invariáveis, descrevendo, desse modo, o comportamento de um gás ideal.

Fonte: Alunos Online
286) Uma certa quantidade de gás com temperatura inicial T_0, pressão P_0 e volume V_0, é aquecida por uma corrente elétrica que flui por um fio de platina num intervalo de tempo Delta t. Esse procedimento é feito duas vezes: primeiro, com volume constante V_0 e pressão variando de P_0 para P_1 e, a seguir, com pressão constante P_0 e volume variando de V_0 para V_1. Assinale a alternativa que explicita a relação C_P/C_V do gás.
- A) large{ large{P_0 over P_1}-1 over large{V_0 over V_1}-1}
- B) large{ large{P_1 over P_0}-1 over large{V_1 over V_0}-1}
- C) large{ large{2P_0 over P_1}-1 over large{V_0 over V_1}-1}
- D) large{ large{2P_1 over P_0}-1 over large{V_1 over V_0}-1}
- E) large{ large{P_1 over P_0}-1 over large{2V_1 over V_0}-1}
A alternativa correta é a letra B) large{frac{P_1}{P_0}-1 over frac{V_1}{V_0}-1}.
Para entender por que essa é a resposta correta,, ofereço a seguinte explicação:
Quando o gás é aquecido a uma temperatura constante, sua pressão aumenta. Além disso, quando o gás é comprimido a uma pressão constante, sua temperatura também aumenta. Isso ocorre porque a temperatura e a pressão do gás estão relacionadas.
Na primeira parte do processo, o volume é mantido constante em $V_0$, e a pressão varia de $P_0$ para $P_1$. Nessa situação, a temperatura do gás aumenta.
Na segunda parte do processo, a pressão é mantida constante em $P_0$, e o volume varia de $V_0$ para $V_1$. Nessa situação, a temperatura do gás também aumenta.
A razão entre a capacidade calorífica a pressão constante ($C_P$) e a capacidade calorífica ao volume constante ($C_V$) é dada pela fórmula:
frac{C_P}{C_V} = frac{P_1/P_0 - 1}{V_1/V_0 - 1}.
Portanto, a alternativa B) é a resposta correta.
Questão 287
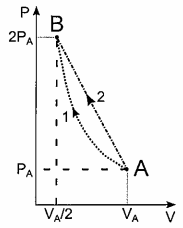
Um mol de certo gás ideal monoatômico, no estado inicial (P_A, V_A, T_B ) deve ter sua pressão dobrada e seu volume reduzido á metade, atingindo o estado (P_B , V_B , T_B ). Para isso, dois processos distintos são testados separadamente: o processo 1 é isotérmico, com o gás cedendo ao meio externo um calor Q_1. Já no processo 2, a curva AB é retilínea, e o calor cedido pelo gás é Q_2 = Q_1/0,92. Sendo R a constante dos gases ideais, o produto RT_A=U_0 e W_1 o trabalho realizado sobre o gás no processo 1, a razão W_1/U_0 vale:
- A) 0,90
- B) 0,75
- C) 0,69
- D) 0,50
- E) 0,32
A alternativa correta é letra C) 0,69
Gabarito: C
Analise o gráfico abaixo.

Um mol de certo gás ideal monoatômico, no estado inicial (P_A, V_A, T_B) deve ter sua pressão dobrada e seu volume reduzido á metade, atingindo o estado (P_B, V_B, T_B). Para isso, dois processos distintos são testados separadamente: o processo 1 é isotérmico, com o gás cedendo ao meio externo um calor Q_1. Já no processo 2, a curva AB é retilínea, e o calor cedido pelo gás é Q_2 = Q_1/0,92. Sendo R a constante dos gases ideais, o produto RT_A=U_0 e W_1 o trabalho realizado sobre o gás no processo 1, a razão W_1/U_0 vale:
Resolução:
Primeiramente, vamos analisar o processo 2. Como a temperatura final é igual a inicial, não há variação de energia interna. Assim, de acordo com a primeira lei da termodinâmica, temos:
Delta U_2 = Q_2 - W_2 = 0
Logo,
Q_2 = W_2
Entretanto, sabemos que o valor de W_2 é numericamente igual à área sob a curva do processo 2, que se trata de um trapézio de base maior 2P_A e base menor P_A e altura V_A/2, como nos mostra a figura a seguir:
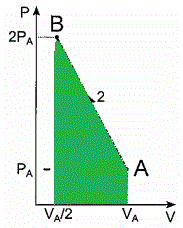
Assim, temos que:
Q_2 = W_2 = dfrac { left( 2 P_A + P_A right) cdot dfrac { V_A } 2 } 2
Q_2 = dfrac { 3 P_A V_A } 4
Entretanto, do enunciado, temos que Q_2 = Q_1/0,92. Então, temos que
dfrac { Q_1 } { 0,92 } = dfrac { 3 P_A V_A } 4
Q_1 = dfrac { 3 cdot 0,92 P_A V_A } 4
Q_1 = dfrac { 2,76 P_A V_A } 4
Q_1 = 0,69 P_A V_A
Por outro lado, de acordo com a lei geral dos gases ideais, temos que P_A V_A = nRT_A. Substituindo-se na equação acima, temos que
Q_1 = 0,69 nRT_A
De acordo com o enunciado, temos que n=1 e RT_A = U_0. Assim, a equação acima se torna
Q_1 = 0,69 cdot 1 cdot U_0
Q_1 = 0,69 U_0 tag 1
Como as temperaturas inicial e final também são iguais para o processo 1, temos que Delta U_1 = 0. Com isso, temos que
Q_1 - W_1 = 0
Logo,
Q_1 = W_1
Assim, substituindo-se Q_1 na equação (1), temos
W_1 = 0,69 U_0
dfrac { W_1 } { U_0 } = 0,69
Portanto, a resposta correta é a alternativa (C).
288) A oxigenoterapia hiperbárica é uma modalidade terapêutica na qual o paciente respira oxigênio puro (100%), enquanto é submetido a uma pressão cerca de 2 a 3 vezes a pressão atmosférica ao nível do mar, no interior de uma câmara hiperbárica. Essa terapia provoca um aumento espetacular na quantidade de oxigênio transportado pelo sangue, na ordem de 20 vezes o volume que circula em indivíduos que estão respirando ar ao nível do mar, o que produzirá no paciente uma série de efeitos de interesse terapêutico.
- A) 1,8n0.
- B) 3,8n0.
- C) 1,4n0.
- D) 0,9n0.
- E) 2,4n0.
A alternativa correta é letra A) 1,8n0.
Partimos da Equação de Clapeyron:
pV = n RT
Em que p, V, T e n são, respectivamente, a pressão , o volume, a temperatura e o número de mols do gás ideal; R é denominada constante universal dos gases ideais.
Dessa fórmula, obtemos que:
dfrac{n}{p} = dfrac{V}{RT}
A questão informa que volume e temperatura são constantes, então todos os fatores de dfrac{V}{RT} são constantes, e podemos chamar essa expressão de uma constate k. Fica:
dfrac{n}{p} = k
Consequentemente, a relação dfrac{n}{p} para condições iniciais left ( dfrac{n_0}{p_0} right ) deve ser igual a relação para condições finais left ( dfrac{n_f}{p_f} right ):
dfrac{n_0}{p_0} = dfrac{n_f}{p_f}
A pressão final deve ser igual a 2,8 n_0 (2,8 vezes a pressão inicial):
dfrac{n_0}{p_0} = dfrac{n_f}{2,8 times p_0}
Simplificando essa equação, obtemos que:
n_f = 2,8 n_0
Para a pressão ser 2,8 vezes a pressão inicial, o número de mols deve ser 2,8 vezes o número de mol inicial. Assim, partindo da quantidade n_0, para obter quantidade igual a n_f, deve ser adicionado o seguinte número:
n_f - n_0
2,8 n_0 - n_0 = 1,8n_0
Gabarito: Letra A.
Questão 289
- A) Os dois compartimentos contêm igual número de mols;
- B) A energia cinética média por molécula é maior no compartimento 2 que no 1;
- C) A massa de uma molécula do compartimento 2 é o dobro da massa de uma molécula do compartimento 1;
- D) As pressões nos dois compartimentos são iguais;
- E) O número de átomos nos compartimentos é igual.
A alternativa correta é letra D) As pressões nos dois compartimentos são iguais;
Questão de teoria cinética dos gases. Vamos obter as informações do enunciado para posteriormente julgarmos as alternativas:
(I) - “Um cilindro fechado que contém hidrogênio...”
O mesmo gás está presente em ambos os compartimentos.
(II) - “...se divide em dois compartimentos desiguais...”
O volume do compartimento 1 é diferente do compartimento 2 e através da figura podemos ver que V_2gt V_1.
(III) - “...por meio de um pistão móvel que no equilíbrio toma a posição mostrada na figura....”
Como o pistão é móvel, se houver uma força resultante em algum dos lados, o pistão se movimentará até ele atingir o equilíbrio. Como dito acima, a figura representa a posição de equilíbrio, portanto
F_1=F_2
Como a área da parede móvel é a mesma para os dois compartimentos (A), dividindo ambos os lados da igualdade anterior pela área, temos:
dfrac{F_1}{A}=dfrac{F_2}{A} ;; implies ;; P_1=P_2
(IV) - “A temperatura é a mesma nos dois compartimentos.”
T_1=T_2
Agora analisando as alternativas:
a) Os dois compartimentos contêm igual número de mols;
Errada. Comentada na alternativa e.
b) A energia cinética média por molécula é maior no compartimento 2 que no 1;
Errada. A energia cinética média de um gás ideal segue a expressão:
E_c=dfrac{3}{2}nRT
Para encontrarmos a energia cinética média por molécula, devemos dividir pelo número de moléculas (N). Sendo N_A o número de Avogadro, temos:
N=n cdot N_A
Dividindo E_c por N temos:
dfrac{E_c}{N}=dfrac{3}{2 n cdot N_A }nRT=dfrac{3}{2 cancel{n} cdot N_A }cancel{n}RT=dfrac{3}{2 cdot N_A }RT=dfrac{3}{2}kT
Onde
k=dfrac{R}{N_A} qquad text {é chamada de constante de Boltzmann}
Da equação anterior, vemos que a energia cinética média por molécula de um gás ideal, depende apenas da temperatura pois todo o restante são constantes. Como T_1=T_2 , as energias também são iguais.
c) A massa de uma molécula do compartimento 2 é o dobro da massa de uma molécula do compartimento 1;
Errada. Como o gás contido nos dois compartimentos é o mesmo, as moléculas possuem mesma massa.
d) As pressões nos dois compartimentos são iguais;
Correta. Como descrito no item (III)
e) O número de átomos nos compartimentos é igual.
Errada. Assumindo que se trata de um gás ideal, com P_1=P_2; mbox{,}; T_1=T_2 ;mbox{e}; V1lt V_2 temos:
PV=nRT ;; implies ;; n=dfrac{PV}{RT}
n_1=dfrac{P_1V_1}{RT_1}
n_2=dfrac{P_2V_2}{RT_2}
Adotando
dfrac{P_1}{RT_1}=dfrac{P_2}{RT_2}=C
n_1=CV_1
n_2=CV_2
Portanto o numero de mols (consequentemente o número de átomos) é proporcional ao volume, como V_2 lt V_1, o número de átomos do compartimento 2 é maior que o número de átomos do compartimento 1.
290) Considere 2 mols de um gás monoatômico ideal, inicialmente a 350K. O gás é aquecido reversivelmente até 500K enquanto seu volume é mantido constante. Determine a variação de entropia do gás. Dado: constante dos gases ideais: R cong 8,3J/mol cdot K.
- A) 8,3,Inleft( {large{7 over 10}} right)J/K
- B) 8,3,In left({large{10 over 7}} right)J/K
- C) 24,9,In left( {large{10 over 7}}right)J/K
- D) 24,9,In left({large{10 over 3}} right)J/K
- E) 24,9,In left({large{7 over 10}} right)J/K
A resposta certa para essa questão é a letra C) 24,9 J/K.
Para determinar a variação de entropia do gás, podemos utilizar a fórmula:
ΔS = n * c_p * ln(T_f / T_i)
onde ΔS é a variação de entropia, n é o número de mols do gás, c_p é a capacidade calorífica específica do gás à pressão constante, T_f é a temperatura final e T_i é a temperatura inicial.
No problema, temos 2 mols de um gás monoatômico ideal, inicialmente à 350 K. O gás é aquecido reversivelmente até 500 K, enquanto seu volume é mantido constante. Para resolver o problema, precisamos encontrar a variação de entropia do gás durante esse processo.
Como o volume é mantido constante, a capacidade calorífica específica do gás à pressão constante (c_p) é igual a 5R/2, onde R é a constante dos gases ideais.
c_p = 5R/2 = 5 * 8,3 J/mol * K / 2 = 20,75 J/mol * K
Agora, podemos utilizar a fórmula para calcular a variação de entropia:
ΔS = n * c_p * ln(T_f / T_i) = 2 mol * 20,75 J/mol * K * ln(500 K / 350 K) = 24,9 J/K
Portanto, a resposta certa é a letra C) 24,9 J/K.




