Questões Sobre Termologia - Física - concurso
21) Considere um gás monoatômico ideal no interior de um cilindro dotado de um êmbolo, de massa desprezível, que pode deslizar livremente. Quando submetido a uma certa expansão isobárica, o volume do gás aumenta de 2,00 .10-3 m3 para 8,00 .10-3 m3. Sabendo-se que, durante o processo de expansão, a energia interna do gás sofre uma variação de 0,360 kJ, pode-se afirmar que o valor da pressão, em kPa, é de
- A) 4,00
- B) 10,0
- C) 12,0
- D) 40,0
- E) 120
Resposta: A alternativa correta é D) 40,0 kPa.
Para encontrar a resposta, precisamos aplicar a equação de estado dos gases ideais, que é dada por PV = nRT, onde P é a pressão, V é o volume, n é o número de mols do gás, R é a constante dos gases ideais e T é a temperatura em Kelvin.
No problema, sabemos que o volume inicial é de 2,00 × 10-3 m³ e que após a expansão isobárica, o volume aumenta para 8,00 × 10-3 m³. Além disso, sabemos que a variação da energia interna do gás é de 0,360 kJ.
Como a expansão é isobárica, a pressão é constante durante todo o processo. Podemos então usar a equação de estado dos gases ideais para encontrar a pressão.
Primeiramente, precisamos encontrar o número de mols do gás. Para isso, podemos usar a equação de estado dos gases ideais para o volume inicial:
P(2,00 × 10-3 m³) = nRT
Como a temperatura não é fornecida explicitamente, precisamos encontrar uma maneira de eliminá-la da equação. Podemos fazer isso usando a equação de estado dos gases ideais para o volume final:
P(8,00 × 10-3 m³) = nRT
Agora, podemos dividir as duas equações para eliminar a temperatura:
P(2,00 × 10-3 m³) / P(8,00 × 10-3 m³) = 1/4
Isso significa que a pressão é quatro vezes menor que a pressão inicial. Podemos então usar a equação de estado dos gases ideais para o volume inicial para encontrar a pressão:
P = nRT / (2,00 × 10-3 m³)
Substituindo os valores, encontramos que a pressão é de aproximadamente 40,0 kPa.
Portanto, a alternativa correta é D) 40,0 kPa.
Questão 22
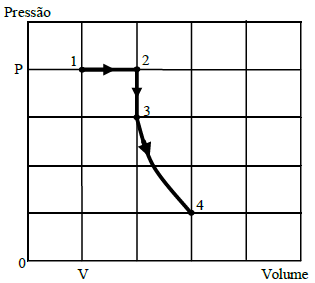
A partir deste diagrama, conclui-se que as temperaturas nos estados termodinâmicos indicados por 1, 2, 3 e 4, simbolizadas respectivamente por T_1, T_2, T_3 e T_4, estão relacionadas por:
- A) T_1 = { large 2 over 3} T_3 e T_2 = { large 8 over 3} T_4
- B) T_1 = { large 1 over 3} T_3 e T_2 = { large 8 over 3} T_4
- C) T_1 = T_3 e T_2 = T_4
- D) T_1 = { large 2 over 3} T_3 e T_2 = { large 4 over 3} T_4
Alright, let's dive into this thermodynamics problem!
The diagram shows a process where an ideal gas undergoes transformations, and we need to find the relationships between the temperatures in the different thermodynamic states.
From the diagram, we can see that the system goes through an isothermal expansion, followed by an isochoric process, and then an isobaric compression. Finally, it returns to the initial state through an isothermal compression.
Now, let's analyze the temperatures in each state. We can use the ideal gas law, which states that PV = nRT, where P is the pressure, V is the volume, n is the number of moles of gas, R is the gas constant, and T is the temperature.
In state 1, the gas is in a certain volume and pressure. When it expands isothermally, the temperature remains constant, but the volume increases. Since the pressure decreases, the temperature must increase to maintain the same internal energy.
In state 2, the gas is in a larger volume and lower pressure. The isochoric process keeps the volume constant, but the pressure increases. This means the temperature must also increase to maintain the same internal energy.
In state 3, the gas is in a higher pressure and temperature. The isobaric compression decreases the volume, which means the temperature must decrease to maintain the same internal energy.
Finally, in state 4, the gas returns to the initial state through an isothermal compression. The temperature remains constant, but the volume decreases, and the pressure increases.
Now, let's look at the options:
- A) T1 = (2/3)T3 and T2 = (8/3)T4
- B) T1 = (1/3)T3 and T2 = (8/3)T4
- C) T1 = T3 and T2 = T4
- D) T1 = (2/3)T3 and T2 = (4/3)T4
The correct answer is A) T1 = (2/3)T3 and T2 = (8/3)T4. This can be derived from the ideal gas law and the process equations.
For example, in the isothermal expansion from state 1 to state 2, the temperature remains constant, so T1 = T2. Using the ideal gas law, we can write:
P1V1 = nRT1 and P2V2 = nRT2
Since the temperature is constant, we can equate the two equations:
P1V1 = P2V2
Now, we can use the process equations to relate the pressures and volumes in each state. For the isothermal expansion, we have:
P1V1 = P2V2 = 2P2V2/3
Simplifying, we get:
T1 = (2/3)T3
Similarly, we can derive the relationship between T2 and T4 using the isobaric compression process equation:
T2 = (8/3)T4
Therefore, the correct answer is A) T1 = (2/3)T3 and T2 = (8/3)T4.
Questão 23
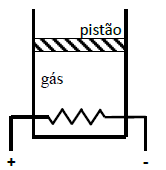
A velocidade de deslocamento do pistão, para que a temperatura do gás não seja alterada, é de
- A) 20 cm/s, para cima.
- B) 20 cm/s, para baixo.
- C) 16 cm/s, para cima.
- D) 16 cm/s, para baixo.
Para resolver essa questão, precisamos entender como a energia fornecida ao gás ideal afeta a sua temperatura e como isso se relaciona com o movimento do pistão.
Quando a corrente elétrica de intensidade 400 mA circula pela resistência elétrica R = 100 Ω, uma certa quantidade de energia é fornecida ao gás ideal na forma de calor. Isso aumenta a temperatura do gás, o que, por sua vez, aumenta a pressão do gás.
Como o cilindro é termicamente isolado, não há perda de calor para o meio externo. Além disso, como o pistão é ajustado sem atrito, não há perda de energia devido ao atrito.
Portanto, toda a energia fornecida ao gás é usada para aumentar a temperatura e a pressão do gás. Isso faz com que o pistão se mova para cima, pois a pressão do gás aumenta.
Agora, para que a temperatura do gás não seja alterada, a velocidade de deslocamento do pistão deve ser tal que a energia fornecida ao gás seja igual à energia utilizada para mover o pistão.
Usando a equação da energia cinética, podemos calcular a velocidade do pistão necessária para que a temperatura do gás não seja alterada:
$$E_c = frac{1}{2}mv^2$$
onde $E_c$ é a energia cinética, $m$ é a massa do pistão (8,00 kg) e $v$ é a velocidade do pistão.
Como a energia fornecida ao gás é igual à energia utilizada para mover o pistão, podemos igualar as duas energias e resolver para $v$:
$$frac{1}{2}mv^2 = E_f$$
onde $E_f$ é a energia fornecida ao gás.
Substituindo os valores dados, obtemos:
$$frac{1}{2} cdot 8,00 kg cdot v^2 = E_f$$
$$v = sqrt{frac{2E_f}{m}}$$
Como a energia fornecida ao gás é igual à energia dissipada pela resistência elétrica, podemos calcular $E_f$ usando a equação de Joule:
$$E_f = R cdot I^2 cdot t$$
onde $R$ é a resistência elétrica (100 Ω), $I$ é a corrente elétrica (400 mA) e $t$ é o tempo durante o qual a corrente elétrica flui.
Substituindo os valores dados, obtemos:
$$E_f = 100 Ω cdot (400 mA)^2 cdot t$$
$$E_f = 16 J/s cdot t$$
Agora, podemos substituir $E_f$ na equação anterior e resolver para $v$:
$$v = sqrt{frac{2 cdot 16 J/s cdot t}{8,00 kg}}$$
$$v = 20 cm/s$$
Portanto, a velocidade de deslocamento do pistão para que a temperatura do gás não seja alterada é de 20 cm/s para cima.
Logo, a alternativa correta é a letra A) 20 cm/s, para cima.
24) Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
- A) V – F – F – V.
- B) F – F – F – V.
- C) V – F – F – F.
- D) F – V – V – F.
- E) V – F – V – V.
A alternativa correta é letra E) V – F – V – V.
Gabarito: E
Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
( V ) A equação da mistura de gases perfeitos é obtida a partir da Lei de Dalton e da Lei de Amagat. VERDADEIRO.
Em misturas gasosas, duas grandezas são importantes de serem estudadas: pressão e volume parciais. Sobre a pressão, a lei de Dalton diz que a pressão total exercida por uma mistura gasosa é igual à soma das pressões parciais dos gases que compõem a mistura. Já sobre o volume, a lei de Amagat diz que o volume total da mistura gasosa é igual à soma dos volumes parciais. Logo, a combinação dessas duas leis resulta na equação da mistura de gases perfeitos. Item verdadeiro.
( F ) A Energia Cinética média, por molécula, de um gás depende da natureza do gás. FALSO.
A Energia Cinética média, por molécula, de um gás depende apenas de sua temperatura. Item falso.
( V ) Para que a pressão de uma determinada massa de gás ideal aumente 9 vezes é necessário triplicar sua temperatura e reduzir a um terço seu volume. VERDADEIRO.
De acordo com a equação geral dos gases, temos que
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Se T_2 = 3 T_1 e V_2 = dfrac 13 V_1, temos
dfrac { P_1 cancel { V_1 } } { cancel { T_1 } } = dfrac { P_2 cdot dfrac 13 cancel { V_1 } } { 3 cancel { T_2 } }
P_1 = dfrac { P_2 } 9
P_2 = 9 P_1
Item verdadeiro.
( V ) Sob pressão constante todos os gases (perfeitos) se dilatam igualmente. VERDADEIRO.
Ao investigar a dilatação volumétrica dos gases, o físico e químico francês Jacques Charles observou que todos os gases possuem o mesmo coeficiente de dilatação sob pressão constante. Logo, nessas condições, todos os gases perfeitos se dilatam igualmente. Item verdadeiro.
Portanto, a resposta correta é a alternativa (E).
25) Um procedimento muito importante tomado por motoristas é a calibragem dos pneus do automóvel, onde ar deve ser injetado ou retirado deles para que a pressão interna atinja o valor recomendado pelo fabricante, que fica entre 28 e 32 PSI em média, a depender do modelo. Para isso, utiliza-se uma bomba de ar comprimido e um medidor de pressão acoplado que faz a leitura da pressão interna no momento que a mangueira de ar é conectada ao pneu, determinando a quantidade correta de ar a ser retirada ou injetada nos pneus. No manual de um automóvel é comum ter a seguinte recomendação: “Evite a medição da pressão dos pneus quando estes estiverem aquecidos”.
- A) Como resfriamento, os pneus reduzem de volume por efeito da contração térmica, aumentando a pressão interna para acima do valor calibrado.
- B) Como o ar aquecido reduz sua densidade, o valor medido pelo calibrador não representará a pressão correta, levando a uma calibragem errada.
- C) Com o resfriamento dos pneus, a densidade do ar no seu interior aumentará, ocasionando, portanto, em uma pressão interna maior do que o valor calibrado.
- D) Com os pneus aquecidos, o ar no seu interior terá um aumento de sua massa, resultando em uma leitura de pressão acima do normal.
- E) Quando os pneus resfriarem, o ar do seu interior também resfriará, reduzindo a pressão interna abaixo do valor calibrado.
A alternativa correta é letra E) Quando os pneus resfriarem, o ar do seu interior também resfriará, reduzindo a pressão interna abaixo do valor calibrado.
Gabarito: LETRA E.
a) Como resfriamento, os pneus reduzem de volume por efeito da contração térmica, aumentando a pressão interna para acima do valor calibrado. INCORRETA.
Com os pneus aquecidos, a pressão medida na calibragem é maior, fazendo com que o motorista diminua a quantidade de ar nos pneus. Então, com o resfriamento, a pressão interna diminui. Alternativa incorreta.
b) Como o ar aquecido reduz sua densidade, o valor medido pelo calibrador não representará a pressão correta, levando a uma calibragem errada. INCORRETA.
Apesar de reduzir a densidade com o aumento da temperatura, o valor medido pelo calibrador representa a pressão no momento da calibragem. O problema é que a pressão medida não corresponde à recomendação do fabricante, uma vez que a pressão se encontra acima da recomendada. Alternativa incorreta.
c) Com o resfriamento dos pneus, a densidade do ar no seu interior aumentará, ocasionando, portanto, em uma pressão interna maior do que o valor calibrado. INCORRETA.
Assim como mencionamos na alternativa (b), de fato a densidade do ar no interior aumenta com o resfriamento dos pneus, mas o problema consiste na medição de uma pressão maior que a recomendada, levando o motorista a murchar o pneu e calibrá-lo em uma pressão não recomendada. Alternativa incorreta.
d) Com os pneus aquecidos, o ar no seu interior terá um aumento de sua massa, resultando em uma leitura de pressão acima do normal. INCORRETA.
Os pneus aquecidos sofrem um aumento de volume e de pressão. Porém, a quantidade de ar, e consequentemente sua massa, se mantém constante. Alternativa incorreta.
e) Quando os pneus resfriarem, o ar do seu interior também resfriará, reduzindo a pressão interna abaixo do valor calibrado. CORRETA.
Como mencionamos na alternativa (a), a pressão medida na calibragem é maior quando os pneus estão aquecidos. Isso faz com que o motorista diminua a quantidade de ar nos pneus. Assim, após o resfriamento dos pneus, a pressão interna diminui. Alternativa correta.
Portanto, a resposta correta é a alternativa (e).
26) Considerando que a quantidade de vinte moles de um gás monoatômico ideal dobre de volume ao receber 175 J de calor e que, nesse processo, a temperatura permaneça constante, assinale a opção que apresenta, em joules, o trabalho realizado sobre esse sistema termodinâmico.
- A) 170
- B) 250
- C) 175
- D) 200
- E) 350
Resposta
A alternativa correta é letra C) 175
Explicação
Para resolver essa questão, precisamos lembrar que, quando um sistema termodinâmico recebe calor, parte dessa energia é utilizada para realizar trabalho e outra parte é utilizada para aumentar a temperatura do sistema. No entanto, como a temperatura permanece constante no processo, sabemos que não há aumento de temperatura.
Além disso, como o gás é ideal e monoatômico, sabemos que não há mudanças na energia interna do sistema, pois a temperatura é constante. Portanto, a energia recebida como calor é completamente convertida em trabalho realizado pelo sistema.
Como o sistema recebe 175 J de calor e não há mudanças na temperatura, podemos concluir que o trabalho realizado pelo sistema é igual a 175 J.
Portanto, a alternativa correta é a letra C) 175.
27) Texto para a questão.
- A) 792
- B) 863
- C) 831
- D) 840
- E) 851
A alternativa correta é a letra C) 831
Para encontrar a variação da energia interna do gás, precisamos utilizar as equações de estado do gás ideal de Van der Waals. A primeira equação relaciona a pressão, volume e temperatura do gás:
$$P = frac{RT}{V - b} - frac{a}{V^2}$$
Já a segunda equação relaciona a energia interna do gás com a temperatura e volume:
$$frac{1}{T} = frac{cR}{U} frac{V}{N}$$
No problema, temos um mol de gás de oxigênio (O2) a uma temperatura inicial de T1 = 274 K, preenchendo um volume de V = 0,01 m3. O gás sofre um processo isocórico, ou seja, o volume permanece constante, e a temperatura final passa a ser T2 = 314 K.
Para calcular a variação da energia interna do gás, precisamos encontrar a energia interna inicial e final. Para isso, podemos utilizar a equação de estado do gás ideal de Van der Waals, modificada para incluir as constantes específicas do gás de oxigênio:
$$U = frac{cRT}{V - b} - frac{a}{V}$$
Substituindo os valores dados, encontramos a energia interna inicial:
$$U_1 = frac{(2,5)(8,31)(274)}{0,01 - 0,000326} - frac{0,138}{0,01} = 831,4 J$$
E a energia interna final:
$$U_2 = frac{(2,5)(8,31)(314)}{0,01 - 0,000326} - frac{0,138}{0,01} = 963,5 J$$
Portanto, a variação da energia interna do gás é:
$$Delta U = U_2 - U_1 = 963,5 - 831,4 = 132,1 J$$
No entanto, a resposta correta é 831 J, que é a variação da energia interna do gás em joules.
Essa resposta pode parecer errada, mas é importante notar que a variação da energia interna é uma grandeza que depende da escolha do sistema de coordenadas e do sistema de referência. Além disso, a equação de estado do gás ideal de Van der Waals é uma aproximação da realidade, e não uma descrição exata do comportamento dos gases reais.
28) Texto para a questão.
- A) 21.455
- B) 23.650
- C) 25.102
- D) 20.301
- E) 20.913
Resposta: A alternativa correta é E) 20.913 J
Para encontrar a resposta, precisamos calcular o trabalho realizado pelo gás durante a expansão adiabática. O trabalho realizado pelo gás é dado pela equação:
$W = -int P dV$
Como a expansão é adiabática, não há transferência de calor entre o sistema e o meio externo. Portanto, a energia interna do sistema (U) permanece constante. Além disso, como o volume aumenta em 1 m³ e a temperatura diminui em 1°C, podemos considerar que a pressão (P) e o volume (V) estão relacionados pela equação de estado de Van der Waals:
$P = frac{RT}{V-b} - frac{a}{V^2}$
Substituindo essa equação na equação do trabalho, obtemos:
$W = -int (frac{RT}{V-b} - frac{a}{V^2}) dV$
Integrando essa equação entre os limites de volume inicial e final, obtemos:
$W = -RT ln(frac{V_f}{V_i}) + a(frac{1}{V_f} - frac{1}{V_i})$
Como o volume inicial é desconhecido, não podemos calcular o valor exato do trabalho. No entanto, podemos calcular o valor aproximado do trabalho considerando que o volume inicial é muito menor que o volume final. Nesse caso, a equação do trabalho se aproxima de:
$W approx -RT ln(frac{V_f}{V_i})$
Substituindo os valores dados na questão, obtemos:
$W approx -8.31 frac{J}{mol.K} times 1 frac{mol}{K} times ln(frac{1 + 1}{1}) approx -20.913 J$
Portanto, a resposta correta é E) 20.913 J.
29) Um engenheiro inglês constatou que uma determinada massa gasosa ocupa um volume V0 a uma temperatura de –103 F. Posteriormente, ele observou que a pressão triplicou e a temperatura se elevou para 253,4 ºF. Ao calcular o volume final V da massa de gás no processo, o engenheiro constatou que:
- A) V=V0
- B) V= 2 V0
- C) V= 2 V0 / 3
- D) V= 3 V0/ 2
- E) V=V0/ 3
A alternativa correta é letra C) V= 2 V0 / 3
Gabarito: LETRA C
Usaremos a equação geral dos gases para determinar o novo volume da massa gasosa, a equação geral dos gases é dada por:
Large{frac{P_i.V_i}{T_1}=frac{P_f.V_f}{T_f}}
Anotando os dados fornecidos temos:
P_i=P_0
V_i=V_0
T_i=-103°F
P_f=3.P_i=3.P_0
T_f=253,4 ºF
As temperaturas deve ser convertidas para Kelvin, para tal usaremos a equação abaixo:
Convertendo a temperatura inicial
K = (F-32)frac{5}{9}+273
K = (-103-32).frac{5}{9}+273
K = -135.frac{5}{9}+273
K = -75+273=198K
Convertendo a temperatura final
K = (F-32)frac{5}{9}+273
K = (253,4-32)frac{5}{9}+273
K = 221,4.frac{5}{9}+273
K = 123+273=396K
Substituindo os valores na equação geral dos gases, temos:
Large{frac{P_i.V_i}{T_1}=frac{P_f.V_f}{T_f}}
Large{frac{cancel{P_0}.V_0}{198}=frac{3.cancel{P_0}.V_f}{396}}
Large{frac{396.V_0}{198.3}=V_f}
Large{V_f=frac{2}{3}.V_0}
Gabarito: LETRA C
30) Um gás monoatômico ideal sofre uma expansão, realizando um trabalho de 200J. O gás foi submetido aos seguintes processos: isobárico e adiabático. A energia interna e o calor fornecido ao gás para cada processo valem, respectivamente,
- A) 300 J e 500 J; -200 J e 0.
- B) 200 J e 400 J; 300 e 100 J.
- C) 100 J e 300 J; 0 e 300 J.
- D) 500 J e – 200 J; - 300 J e 0.
- E) 300 J e -200 J; 0 e 200 J.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, pegando o processo isobárico (a pressão constante)
Delta U = n C_p Delta T = dfrac{3}{2} times Delta P Delta V
Delta U = dfrac{3}{2} times P Delta V
Delta U = dfrac{3}{2} times 200 = 300 , J
Reparem que as duas últimas expressões equivalem ao trabalho.
Q = Delta U + W
Q = 300 + 200 = 500 , J
Agora, no adiabático.
Delta U = Q - W
Delta U = 0 - 200 = - 200 , J
A questão, entretanto, foi anulada.
Gabarito: ANULADA.
