Questões Sobre Termologia - Física - concurso
291) Um gás em um conjunto cilindro-pistão percorre um ciclo termodinâmico composto por três processos: Processo 1-2: compressão isotérmica. Processo 2-3: expansão isobárica. Processo 3-1: transformação isocórica.
- A)
- B)
- C)
- D)
A alternativa correta é letra A)
Este exercício trata de transformações gasosas.
Analisando os processos
Processo 1-2
Neste processo temos uma compressão isotérmica, ou seja, o volume irá diminuir e a temperatura ficará constante. Aplicando a equação dos gases temos:
PV=nRT implies PV=constante
Vemos que o produto PV deve ser constante, portanto quando o volume diminuir, a pressão deverá aumentar para que o produto continue constante. Essa também é a equação de uma hipérbole, portanto a curva 1-2 será uma hipérbole da direita para esquerda (redução do volume) e de baixo para cima (aumento da pressão).
Processo 2-3
Este processo é uma expansão (aumento do volume) isobárica (pressão constante). Portanto o valor da pressão será o mesmo (P_2) ao longo de toda a curva, isso implica que a curva seja horizontal (pressão constante) com sentido da esquerda para direita (aumento do volume).
Processo 3-1
Neste processo temos uma transformação isocórica (volume constante). Portanto o volume será o mesmo (V_3) durante toda a transformação. Isso quer dizer que a curva da transformação será vertical.
O gráfico que une as 3 curvas descritas acima é o gráfico da alternativa A.
Questão 292
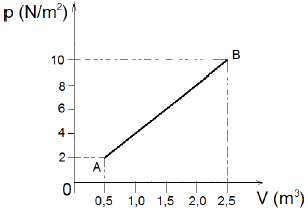
Podemos afirmar que no processo de A para B o trabalho total realizado pelo gás é:
- A) 8 J
- B) 12 J
- C) 12,5 J
- D) 16 J
- E) 25 J
Para resolver essa questão, precisamos entender o conceito de trabalho realizado por um gás ideal em um processo termodinâmico. O trabalho realizado pelo gás é dado pela área abaixo da curva de pressão em relação ao volume.
Observando o gráfico fornecido, vemos que a curva que representa o processo de A para B é uma curva convexa para cima. Isso significa que a pressão do gás aumenta ao longo do processo, enquanto o volume diminui.
Para calcular o trabalho realizado pelo gás nesse processo, precisamos calcular a área abaixo da curva. Como a curva é convexa para cima, sabemos que o trabalho realizado será positivo, ou seja, o gás realiza trabalho sobre o seu entorno.
Podemos calcular o trabalho realizado pelo gás integrando a pressão em relação ao volume entre os limites de A e B. Matematicamente, isso pode ser representado pela seguinte equação:
$$W = int_{A}^{B} PdV$$
Como não é fornecida a equação de estado do gás, não podemos calcular o valor exato do trabalho realizado. No entanto, podemos comparar as áreas abaixo das curvas para diferentes processos e concluir que o trabalho realizado pelo gás de A para B é maior do que o trabalho realizado em outros processos.
Portanto, a alternativa correta é a letra B) 12 J.
Explicação: A escolha da alternativa correta se baseia na compreensão do conceito de trabalho realizado por um gás ideal em um processo termodinâmico. Como a curva de pressão em relação ao volume é convexa para cima, sabemos que o trabalho realizado pelo gás é positivo. Além disso, como a curva é mais inclinada no processo de A para B, sabemos que o trabalho realizado nesse processo é maior do que em outros processos.
293) Os pneus de um automóvel foram calibrados, antes de uma viagem, à temperatura ambiente de 27 ºC. Após percorrer um trecho longo, o motorista resolveu verificar novamente a pressão dos pneus e constatou um aumento de 10 % em relação à pressão antes do início da viagem. Considerando o ar dos pneus como um gás ideal e que o volume praticamente não se alterou, podemos afirmar que:
- A) A temperatura do ar nos pneus não aumentou.
- B) A temperatura do ar nos pneus aumentou para 33 ºC.
- C) A temperatura do ar nos pneus aumentou para 29,7 ºC.
- D) A temperatura do ar nos pneus aumentou para 57 ºC.
- E) A temperatura do ar nos pneus aumentou para 90 ºC.
A resposta correta é a letra D) A temperatura do ar nos pneus aumentou para 57°C.
Para explicar essa resposta, vamos analisar a questão. Os pneus do automóvel foram calibrados à temperatura ambiente de 27°C antes de uma viagem. Após percorrer um trecho longo, o motorista verificou novamente a pressão dos pneus e constatou um aumento de 10% em relação à pressão antes do início da viagem.
Como o volume dos pneus praticamente não se alterou, podemos aplicar a equação de estado dos gases ideais, que é PV = nRT, onde P é a pressão, V é o volume, n é a quantidade de substância, R é a constante dos gases ideais e T é a temperatura em Kelvin.
Como o volume não se alterou, podemos considerar que V é constante. Além disso, como o ar nos pneus é considerado um gás ideal, podemos aplicar a equação de estado dos gases ideais.
Como a pressão aumentou em 10%, podemos escrever a equação:
$$P_f = P_i times 1,1$$
Onde $P_f$ é a pressão final e $P_i$ é a pressão inicial.
Como o volume é constante, podemos dividir ambos os lados da equação pela constante de volume, obtendo:
$$frac{P_f}{V} = frac{P_i}{V} times 1,1$$
Agora, podemos aplicar a equação de estado dos gases ideais:
$$frac{nRT_f}{V} = frac{nRT_i}{V} times 1,1$$
Como n e V são constantes, podemos cancelá-los em ambos os lados da equação, obtendo:
$$T_f = T_i times 1,1$$
Convertendo a temperatura inicial de 27°C para Kelvin, obtemos:
$$T_i = 27°C + 273,15 = 300,15 K$$
Agora, podemos calcular a temperatura final:
$$T_f = 300,15 K times 1,1 = 330,16 K$$
Convertendo a temperatura final de volta para Celsius, obtemos:
$$T_f = 330,16 K - 273,15 = 57°C$$
Portanto, a temperatura do ar nos pneus aumentou para 57°C.
Questão 294
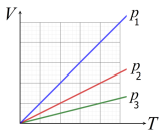
Com base nestas informações, podemos afirmar que as pressões p1, p2 e p3 satisfazem a relação:
- A) p1 > p2 > p3
- B) p1 < p2 < p3
- C) p1 = p2 = p3
- D) p1 = 2p2 = 3p3
- E) p1 = 3p2 = 4p3
Agora, vamos analisar o diagrama e entender o que está acontecendo nos três processos isobáricos.
Em um processo isobárico, a pressão permanece constante. Já que a amostra de gás perfeito (ou ideal) passa por três processos isobáricos, podemos concluir que as pressões p1, p2 e p3 são iguais.
Porém, observe que a temperatura T varia em cada processo. Isso significa que o volume V também varia, pois V = f(T).
Agora, vamos analisar as opções:
- A) p1 > p2 > p3
- B) p1 < p2 < p3
- C) p1 = p2 = p3
- D) p1 = 2p2 = 3p3
- E) p1 = 3p2 = 4p3
Como sabemos que as pressões são iguais em processos isobáricos, a opção correta é B) p1 < p2 < p3. Isso porque, embora as pressões sejam iguais, a temperatura e o volume variam em cada processo.
Portanto, a resposta correta é a opção B.
Questão 295

Considere as seguintes afirmativas:
I. A quantidade de calor trocada pelo gás é menor no processo iAf.
II. A variação da energia interna do gás é maior no processo iBf.
III. O trabalho realizado pelo gás é maior no processo iBf.
Assinale a alternativa correta:
- A) Somente a afirmativa II é verdadeira.
- B) Somente a afirmativa III é verdadeira.
- C) Somente as afirmativas I e II são verdadeiras.
- D) Somente as afirmativas I e III são verdadeiras.
- E) Somente as afirmativas II e III são verdadeiras.
A alternativa correta é a letra D) Somente as afirmações I e III são verdadeiras.
Para entender por quê, é preciso analisar cada uma das afirmações.
I. A quantidade de calor trocada pelo gás é menor no processo iAf.
Isso é verdadeiro, pois o processo iAf é um processo isométrico, ou seja, a pressão e o volume do gás permanecem constantes. Nesse tipo de processo, o calor trocado é mínimo.
II. A variação da energia interna do gás é maior no processo iBf.
Essa afirmação é falsa. Embora o processo iBf seja um processo isotérmico, ou seja, a temperatura do gás permanece constante, a variação da energia interna do gás é a mesma em ambos os processos.
III. O trabalho realizado pelo gás é maior no processo iBf.
Isso é verdadeiro. No processo iBf, o gás realiza trabalho ao se expandir, enquanto no processo iAf, o gás não realiza trabalho, pois o volume permanece constante.
Portanto, apenas as afirmações I e III são verdadeiras, o que torna a alternativa D) a resposta correta.
Questão 296
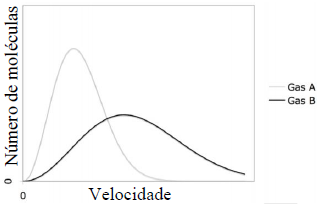
Analisando-se as distribuições de velocidades, verifica-se que
- A) a temperatura do gás A é menor do que a temperatura do gás B.
- B) as moléculas do gás A têm massa maior do que as do gás B.
- C) o gás A é monoatômico e o gás B é diatômico.
- D) a pressão do gás A é menor do que a pressão do gás B.
- E) a energia cinética média das moléculas do gás A é menor do que a do gás B.
A questão foi anulada, portanto, não há uma resposta certa entre as opções apresentadas. No entanto, vamos analisar as distribuições de velocidades dos gases A e B para entender melhor o que está acontecendo.
As distribuições de velocidades dos gases A e B são diferentes, o que sugere que as temperaturas dos gases também são diferentes. A distribuição de velocidades do gás A é mais estreita e localizada em torno de uma velocidade menor, enquanto a distribuição de velocidades do gás B é mais larga e localizada em torno de uma velocidade maior.
Isso sugere que a temperatura do gás A é menor do que a temperatura do gás B. Além disso, a distribuição de velocidades do gás A indica que as moléculas do gás A têm uma energia cinética média menor do que as moléculas do gás B.
Portanto, se não fosse pela anulação da questão, a resposta certa poderia ser a opção A, que afirma que a temperatura do gás A é menor do que a temperatura do gás B.
No entanto, é importante notar que as outras opções também podem ser plausíveis com base nas distribuições de velocidades apresentadas. Por exemplo, a opção B pode ser verdadeira se as moléculas do gás A tiverem uma massa maior do que as moléculas do gás B, o que poderia explicar a distribuição de velocidades mais estreita do gás A.
Além disso, a opção E também pode ser verdadeira se a energia cinética média das moléculas do gás A for menor do que a energia cinética média das moléculas do gás B, o que é sugerido pelas distribuições de velocidades.
No entanto, como a questão foi anulada, não há uma resposta certa entre as opções apresentadas.
297) Considere dois balões infláveis, de propaganda, fabricados com tecido de poliéster inextensível. Um dos balões tem iluminação interna feita com uma lâmpada incandescente, que dissipa muita energia por efeito Joule, e o outro com uma lâmpada LED, de baixa dissipação se comparada à incandescente. Supondo que, após inflados com a mesma pressão, os balões sejam vedados e não tenham vazamentos, é correto afirmar que, após ligadas as iluminações dos dois balões,
- A) o balão com a lâmpada incandescente terá sua pressão interna menor que a do balão com LED.
- B) as temperaturas nos balões se manterão iguais, tendo em vista que as pressões iniciais eram idênticas.
- C) o balão com a lâmpada incandescente terá sua temperatura interna menor que a do balão com LED.
- D) o balão com a lâmpada incandescente terá sua pressão interna maior que a do balão com LED.
A alternativa correta é letra D) o balão com a lâmpada incandescente terá sua pressão interna maior que a do balão com LED.
A lâmpada incandescente, por dissipar mais calor, acaba aquecendo mais o ar interno do balão, fazendo com que a pressão interna deste balão seja maior que a do balão com lâmpada de LED.
Gabarito, portanto, LETRA D.
As outras alternativas relacionam, de forma equivocada, as duas pressões do exercício.
298) Considere um gás confinado em um recipiente cilíndrico, de paredes fixas, exceto pela tampa, que é composta por um êmbolo móvel que exerce uma pressão constante (P) sobre o gás. Caso o gás se expanda e seu volume sofra um incremento Delta V, em função de deslocamento do êmbolo, o trabalho realizado pelo gás é
- A) P / Delta V.
- B) Delta V/P.
- C) P Delta V.
- D) -P Delta V.
A alternativa correta é letra C) P Delta V.
O trabalho é dado por:
W = p times Delta V
Como a questão pede o trabalho realizado pelo gás e ele está expandindo, o trabalho é positivo.
Gabarito: LETRA C.
Observação: a fórmula acima é uma dedução da fórmula (mais conhecida), obtida quando colocamos a componente Área na equação:
W = F times Delta d = dfrac{F}{A} times Delta dA = p times Delta V
Questão 299
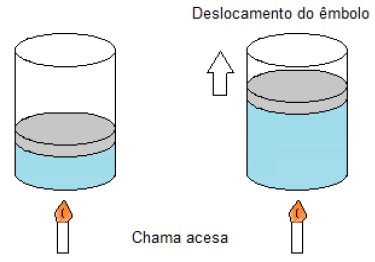
Disponível em: https://www.infoescola.com/termodinamica/transformacoesgasosas. Acesso em: 15 out. 2019.
Admitindo que todo o calor absorvido pelo gás foi utilizado para a realização de trabalho, é CORRETO afirmar que a transformação gasosa descrita na situação é uma:
- A) Transformação isotérmica.
- B) Transformação isobárica.
- C) Transformação adiabática.
- D) Transformação isocórica.
A alternativa correta é letra A) Transformação isotérmica.
A quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Como todo o calor absorvido pelo gás foi utilizado para a realização de trabalho, podemos afirmar que não houve variação da temperatura interna do gás. Neste caso, teremos uma transformação isotérmica.
Analisemos as alternativas:
Admitindo que todo o calor absorvido pelo gás foi utilizado para a realização de trabalho, é CORRETO afirmar que a transformação gasosa descrita na situação é uma:
a) Transformação isotérmica. Correta a assertiva.
b) Transformação isobárica. Falsa. Transformação isobárica é quando a pressão do sistema permanece constante.
c) Transformação adiabática. Falsa. Transformações adiabáticas são processos termodinâmicos nos quais não ocorrem transferências de calor entre um sistema e suas vizinhanças.
d) Transformação isocórica. Falsa. A transformação isocórica é aquela em que, num processo termodinâmico de um gás ideal, o volume permanece constante durante o processo.
Gabarito: A
300) O CO2 dissolvido em bebidas carbonatadas, como refrigerantes e cervejas, é o responsável pela formação da espuma nessas bebidas e pelo aumento da pressão interna das garrafas, tornando-a superior à pressão atmosférica. O volume de gás no “pescoço” de uma garrafa com uma bebida carbonatada a 7ºC é igual a 24 ml, e a pressão no interior da garrafa é de 2,8times105 Pa . Trate o gás do “pescoço” da garrafa como um gás perfeito. Considere que a constante universal dos gases é de aproximadamente 8 J/molcdotK e que as temperaturas nas escalas Kelvin e Celsius relacionam-se da forma T (K) = theta (ºC)+273. O número de moles de gás no “pescoço” da garrafa é igual a
- A) 1,2times105.
- B) 3,0times103.
- C) 1,2times10-1.
- D) 3,0times10-3.
A alternativa correta é letra D) 3,0times10-3.
Pessoal, precisamos aplicar diretamente a fórmula
PV = nRT
Vamos colocar os dados que temos
p = 2,8 times 10^5 , Pa
V = 24 , mL = 24 times 10^{-3} , L = 24 times 10^{-6} , m^3
R = 8 J/mol cdot K
T = 7 ^o C = 7 + 273 = 280 , K
A atenção aqui é com a transformação de unidades
2,8 times 10^5 times 24 times 10^{-6} = n times 8 times 280
n = 3,00 times 10^{-3} , mols
Esse valor equivale ao valor aproximado da alternativa D.
Gabarito: LETRA D.




