Questões Sobre Termologia - Física - concurso
301) Novas teorias científicas afirmam que a água está extremamente ligada à formação do Sistema Solar. A alternância das etapas de aquecimento e resfriamento da Terra possibilitou a condensação deste vapor que se materializou na forma de chuva, depositando assim a água nas partes mais baixas, surgindo os “oceanos primitivos”. Durante a formação da costa terrestre os vulcões expeliam tanto o hidrogênio como o vapor de água e auxiliaram na formação da atmosfera terrestre. A este processo, denomina-se
- A) calefação.
- B) desgaseificação.
- C) fusão.
- D) fissão.
A alternativa correta é letra B) desgaseificação.
Gabarito: LETRA B
a) calefação.
DEFINIÇÃO: Calefação fenômeno que consiste no aparecimento de uma camada ou colchão de vapor entre um líquido e uma superfície quando esta se encontra fortemente aquecida.
b) desgaseificação.
CORRETO
DEFINIÇÂO: Desgaseificação é o processo físico da lenta liberação de gases quando presos, de materiais congelados, absorventes ou adsorventes. Assim, durante a formação da atmosfera terrestre o processo predominante foi a desgaseificação.
c) fusão.
DEFINIÇÃO: Fusão transição da fase sólida para a fase líquida de uma substância ou mistura.
d) fissão.
DEFINIÇÃO: Fissão "Nuclear"O processo de fissão ocorre quando um elemento pesado divide-se em outros dois elementos mais leves.
Gabarito: LETRA B
Questão 302

O gás realiza trabalhos totais τ_I, τ_{II} e τ_{III} respectivamente nas transformações I, II e III. Nessas condições, é correto afirmar que
- A) nas transformações I e II, há conversão de calor em trabalho pelo gás e τ_I > τ_{II}.
- B) na transformação III, há conversão de trabalho em calor pelo gás e τ_{III} > τ_I > τ_{II}.
- C) as quantidades de calor trocadas pelo gás com o meio externo nas transformações I, II e III são iguais.
- D) o trabalho total τ_I é positivo enquanto que τ_{III} e τ_{II} são negativos.
A alternativa correta é letra A) nas transformações I e II, há conversão de calor em trabalho pelo gás e τ_I > τ_{II}.
ALTERNATIVA CORRETA: LETRA A
Na transformação cíclica o estado final é igual ao estado inicial, implica que a variação da energia interna é nula (Delta U = 0).Sabendo que: Delta U = Q - tau
temos que: tau = QPortanto, no ciclo existe uma equivalência entre o calor trocado Q e o trabalho realizado W.Sinal do Trabalho
- Se a transformação for realizada no sentido horário, há uma conversão de calor em trabalho, ou seja, o trabalho é maior do que zero (tau>0).
- Se a transformação for realizada no sentido anti-horário existe uma conversão de trabalho em calor, ou seja, o trabalho é menor do que zero (tau<0).
Para os gráficos fornecidos temos que o trabalho pode ser obtido através da área do gráfico e seus sinais de acordo com o sentido do ciclo:
tau_I=tau=9PV=Q_I
tau_{II}=frac{tau}{2}=frac{9}{2}PV=Q_{II}
tau_{III}=-frac{tau}{2}=-frac{9}{2}PV=Q_{III}
Nos ciclos termodinâmicos temos, a máquina térmica e o refrigerador
a) nas transformações I e II, há conversão de calor em trabalho pelo gás e tau_I>tau{II}.
CORRETA
Há conversão de calor em trabalho pelo gás: Q_Q=Q_F+tau
tau_I>tau_{II}
tau>frac{tau}{2}
b) na transformação III, há conversão de trabalho em calor pelo gás e tau_{III}>tau_{I}>tau_{II}.
ERRADA
JUSTIFICATIVA: Há conversão de trabalho em calor pelo gás (Correto, pois se trata de um refrigerador)
tau_{III}<tau_{II}<tau_I.
c) as quantidades de calor trocadas pelo gás com o meio externo nas transformações I, II e III são iguais.
ERRADA
JUSTIFICATIVA:
Q_I=9PV
Q_{II}=frac{9}{2}PV
Q_{III}=-frac{9}{2}PV
d) o trabalho total tau_I é positivo enquanto que tau_{III} ~e~ tau_{II} são negativos.
ERRADA
JUSTIFICATIVA:
tau_I>0
tau_{II}>0
tau_{III}<0
ALTERNATIVA CORRETA: LETRA A
Questão 303
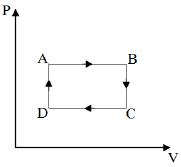
Assinale a alternativa que indica corretamente as transformações termodinâmicas pelas quais a energia interna da amostra aumentou.
- A) DA e CD
- B) AB e BC
- C) AB e DA
- D) BC e CD
A alternativa correta é letra C) AB e DA
Gabarito: LETRA C.
Para resolver a questão, devemos lembrar que um gás perfeito é um sistema ideal que obedece a lei geral dos gases ideais, descrita na equação a seguir:
dfrac {PV}{T} = mathrm{constante} tag 1
Onde P é a pressão, V é o volume e T é a temperatura do sistema.
Além disso, devemos lembrar também que a energia interna de um gás está relacionada com a temperatura de forma que quando há um aumento da temperatura, ocorre o aumento da energia interna e quando a temperatura diminui, a energia interna também diminui.
No processo AB, o gás sofre uma expansão (V_B gt V_A) a pressão constante. Da equação (1), temos que volume e temperatura são diretamente proporcionais. Assim, no processo AB o aumento de volume a pressão constante provoca um aumento na temperatura e, consequentemente, um aumento na energia interna do sistema.
No processo BC, o gás sofre uma diminuição de pressão (P_C lt P_B) a volume constante. Da equação (1), temos que pressão e temperatura também são diretamente proporcionais. Assim, no processo BC, a diminuição de pressão a volume constante provoca uma diminuição na temperatura e, consequentemente, uma diminuição na energia interna do sistema.
No processo CD, ocorre o inverso do processo AB, ou seja, há uma diminuição de a pressão constante. Logo, há uma diminuição na energia interna do sistema.
No processo DA, ocorre o inverso do processo BC, ou seja, há um aumento de pressão a volume constante. Logo, há um aumento na energia interna do sistema.
Portanto, a resposta correta é a alternativa (C).
304) Um carro-tanque, cujo volume é de 24 m3 , transporta um certo gás, mantendo a temperatura constante de 20 ºC, a uma pressão de 2 atm. Chegando ao seu destino, o gás foi transferido para um reservatório de 60 m3 , mantido a uma temperatura de 293 K. Assim, é correto afirmar que:
- A) o gás sofreu uma transformação isotérmica.
- B) o gás sofreu uma transformação isocória.
- C) o gás sofreu uma transformação isobárica.
- D) a pressão passou a ser de 1 atm.
- E) a temperatura do gás sofreu uma grande alteração.
A alternativa correta é letra A) o gás sofreu uma transformação isotérmica.
Gabarito: LETRA A.
Utilizando a equação geral dos gases ideais, temos que
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 } tag 1
De acordo com o enunciado, temos que:
begin{cases} P_1 = 2 , atm \ V_1 = 24 , m^3 \ T_1 = 20º = 293 , K end {cases}
e, ainda,
begin{cases} V_2 = 60 , m^3 \ T_2 = 293 , Kend {cases}
Note que T_1 = T_2 = 293 , K, ou seja, o gás sofreu uma transformação isotérmica. Logo, a alternativa (a) está correta e as alternativas (b), (c) e (e) estão incorretas.
Substituindo-se os valores do enunciado, a equação (1) se torna
dfrac { 2 cdot 24 } { cancel { 293 } } = dfrac { P_2 cdot 60 } { cancel { 293 } }
P_2 = 0,8 , atm
Logo, a alternativa (d) está incorreta.
Portanto, a resposta correta é a alternativa (a).
305) Um balão de volume V= 50 1 está cheio de gás hélio e amarrado por uma corda de massa desprezível a um pequeno objeto de massa m. Esse balão encontra-se em um ambiente onde a temperatura é de 27 ºC e a pressão vale 1 atm. Considerando-se que a pressão no interior do balão seja de 2 atm e que o gás está em equilíbrio térmico com o exterior, qual deve ser o menor valor possível da massa m, para que o balão permaneça em repouso? (Dados: Massa molar do ar= 29,0 g/mol; massa molar do gás Hélio = 4,0 g/ mol; constante universal dos gases R = 0,082 atm.1/mol.K; considere a massa do material que reveste o balão desprezível e todos os gases envolvidos no problema gases ideais.)
- A) 16 g
- B) 22 g
- C) 29 g
- D) 37 g
- E) 43 g
A alternativa correta é letra E) 43 g
Gabarito: LETRA E.
Sabemos que o ar exerce uma força de empuxo vec E sobre o balão. Assim, vamos representar a ação das forças que atuam sobre o sistema:
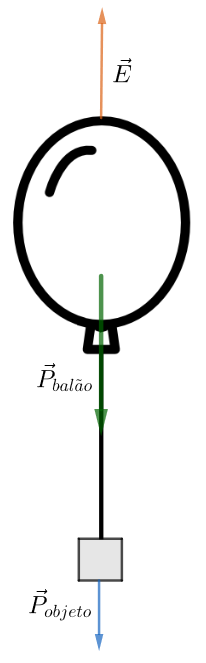
A condição para que o balão permaneça em repouso é dada por:
E - P_{balão} - P_{objeto} = 0
Logo,
rho_{ar} cdot V cdot cancel g- m_{He} cdot cancel g - m cdot cancel g= 0
m = rho_{ar} cdot V - m_{He}
Como rho_{He} = dfrac { m_{He} } V, temos
m = rho_{ar} cdot V - rho_{He} cdot V
m = left( rho_{ar} - rho_{He} right) cdot V tag 1
Sabemos que a densidade rho de uma substância de massa m e volume V é dada por
rho = dfrac { m } { V }
Porém, como a massa m dessa substância pode ser escrita em função de sua massa molar MM e o número de mols n através da relação m = n cdot MM, a equação acima se torna:
rho = dfrac { n cdot MM } { V } tag 2
Da equação geral dos gases ideais, temos que
PV = nRT
Logo,
dfrac { n } { V } = dfrac { P } { RT } tag 3
Substituindo (3) em (2), temos:
rho = dfrac { P } { RT } cdot MM tag 4
Substituindo (4) em (1), temos
m = left( dfrac { P_{ar} cdot MM_{ar} } { RT } - dfrac { P_{He} cdot MM_{He} } { RT } right) cdot V
m = left( P_{ar} cdot MM_{ar} - P_{He} cdot MM_{He} right) cdot dfrac { V } { RT }
Substituindo os valores do enunciado, temos
m = left( 1 cdot 29,0 - 2 cdot 4,0 right) cdot dfrac { 50 } { 0,082 cdot left( 273 + 27 right) }
m = 21 cdot dfrac { 50 } { 24,6 }
m approx 43 , g
Portanto, a resposta correta é a alternativa (e).
Questão 306

A expansão adiabática viabiliza o resfriamento do N2 porque
- A) a entrada de calor que ocorre na expansão por causa do trabalho contribui para a diminuição da temperatura.
- B) a saída de calor que ocorre na expansão por causa do trabalho contribui para a diminuição da temperatura.
- C) a variação da energia interna é nula e o trabalho é associado diretamente ao fluxo de calor, que diminui a temperatura do sistema.
- D) a variação da energia interna é nula e o trabalho é associado diretamente à entrada de frio, que diminui a temperatura do sistema.
- E) o trabalho é associado diretamente à variação de energia interna e não há troca de calor entre o gás e o ambiente.
A alternativa correta é letra E) o trabalho é associado diretamente à variação de energia interna e não há troca de calor entre o gás e o ambiente.
O comando da questão menciona uma informação importantíssima para nossa resolução: o processo é adiabático.
O que vem a ser isso? No processo adiabático não ocorre troca de calor com o meio externo
Assim, pela primeira lei da termodinâmica (princípio da conservação da energia para os sistemas termodinâmicos), temos que:
ΔU = Q - τ
Em que:
ΔU – variação de energia interna (cal ou J)
Q – calor (cal ou J)
τ – trabalho (cal ou J)
Podemos também expressar da seguinte forma:
Q = ΔU + τ
Sabemos que não ocorre troca de calor, logo, Q = 0.
Daí podemos pensar em:
ΔU = - τ
Vamos analisar as alternativas apresentadas.
a) a entrada de calor que ocorre na expansão por causa do trabalho contribui para a diminuição da temperatura.
ERRADO. Por ser adiabática não temos entrada de calor (Q=0)
b) a saída de calor que ocorre na expansão por causa do trabalho contribui para a diminuição da temperatura.
ERRADO. Por ser adiabática não temos entrada nem saída de calor (Q=0)
c) a variação da energia interna é nula e o trabalho é associado diretamente ao fluxo de calor, que diminui a temperatura do sistema.
ERRADO. Por ser adiabática não temos fluxo de calor.
d) a variação da energia interna é nula e o trabalho é associado diretamente à entrada de frio, que diminui a temperatura do sistema.
ERRADO. A variação de energia não é nula. Apenas a troca de calor. Vimos acima que ΔU = - τ. Logo, a variação de energia interna não é nula.
e) o trabalho é associado diretamente à variação de energia interna e não há troca de calor entre o gás e o ambiente.
CERTO. Vimos isso no item acima (ΔU = - τ). Estes são diretamente proporcionais.
Se ocorrer o aumento o ΔU teremos o aumento o trabalho (τ)
307) Em um gás ideal, considere as curvas isotermas de pressão e volume (PV), e as curvas isobáricas, de volume e temperatura (VT). É correto afirmar que os gráficos
- A) PV são retas e as VT são hipérboles.
- B) PV e VT são hipérboles.
- C) PV são hipérboles e as VT são retas.
- D) PV e VT são retas.
A alternativa correta é letra C) PV são hipérboles e as VT são retas.
Como o gás é ideal, ele segue a equação de Clapeyron:
P,V = n,R,T
Para uma curva isoterma (temperatura constante) notamos que o membro direito da equação acima, o produto (nRT) será constante, sendo assim, podemos substituir todo o membro direito por uma constante (C_1):
PV = C_1
A equação acima representa uma hipérbole retangular. Logo, podemos afirmar que as curvas isotermas de pressão e volume (PV) são hipérboles.
Para uma curva isobárica (pressão constante) os termos n, R e P serão constantes. Reescrevendo a equação de Clapeyron e unindo os termos constantes:
PV = nRT
V = dfrac{nR,T}{P}
V =left( dfrac{nR}{P}right),T
V (T) = C_2,T
Podemos ver que a de volume em função da temperatura é linear e representa uma reta. Sendo assim, as curvas isobáricas representadas nos eixos (VT) serão retas.
Sendo assim, podemos afirmar que as curvas isotermas (PV) são hipérboles e as isobáricas (VT) são retas.
308) Um kit para oxigenoterapia contém um cilindro pequeno de oxigênio medicinal. O fabricante do kit injeta 0,420 m3 de oxigênio no cilindro, que tem um volume interno de 3,00 L. Nesse processo, a temperatura do gás permanece constante. Considerando o oxigênio como um gás ideal, com pressão inicial de 1,00 atm, calcule a pressão do oxigênio no interior do cilindro. Dado: 1 m3 = 1000 L.
- A) 70,0 atm
- B) 140 atm
- C) 210 atm
- D) 280 atm
- E) 350 atm
A alternativa correta é letra B) 140 atm
Quando um gás ideal sofre uma alteração nas suas variáveis de estado, dizemos que este gás sofrEu uma transformação. As transformações dos gases ideais são regidas pela equação:
dfrac{P_1cdot V_1}{T_1}=dfrac{P_2cdot V_2}{T_2}
Onde P_1, V_1 e T_1 são respectivamente a pressão o volume e a temperatura no estado inicial e P_2, V_2 e T_2 as variáveis no estado final (dentro do cilindro). Adotando o mesmo valor (T) para as temperaturas T_1 e T_2 e organizando os dados do enunciado:
- P_1 = 1,atm;
- V_1 = 0,420,m^3 = 0,420times 1,000,L = 420,L;
- T_1 = T;
- V_2 = 3,0,L;
- T_2=T.
Substituindo os valores na equação:
dfrac{1 cdot 420}{T}=dfrac{P_2cdot 3}{T}
dfrac{420}{cancel{T}}=dfrac{3P_2}{cancel{T}}
420=3P_2
P_2 = dfrac{420}{3}
bbox[8px, border: 1px solid black]{color{black}{P_2 = 140,atm}}
Logo, a pressão do oxigênio no interior do cilindro é de 140 atm.
309) “Em uma transformação isotérmica, quando a pressão aumenta, podemos afirmar que o trabalho é ____________ e o volume é ______________ proporcional à ______________.” Assinale a alternativa que completa correta e sequencialmente a afirmativa anterior.
- A) positivo / diretamente / pressão
- B) negativo/ inversamente / pressão
- C) positivo / diretamente / temperatura
- D) negativo / inversamente / temperatura
A alternativa correta é letra B) negativo/ inversamente / pressão
Vamos estudar a transformação proposta no enunciado através da equação de Clapeyron:
P,V = n,R,T
Como em uma transformação isotérmica a temperatura permanece constante, todo o lado direito da equação é constante e podemos reescrever a equação acima:
P,V = C
Onde C é uma constante, logo, o produto da pressão pelo volume é constante. Através deste resultado podemos afirmar que a pressão e o volume são inversamente proporcionais. Com este resultado podemos completar uma parte da afirmação do exercício:
“Em uma transformação isotérmica, quando a pressão aumenta, podemos afirmar que o trabalho é ____________ e o volume é inversamente proporcional à pressão.”
Por fim, devemos analisar o que ocorre quando a pressão aumenta. Como explicado, quando a pressão aumenta, o volume diminui, pois são inversamente proporcionais. Com a redução do volume o gás está recebendo um trabalho do meio externo e não realizando trabalho, por este motivo o trabalho é considerado como negativo.
Sendo assim, a afirmativa preenchida da maneira correta é:
“Em uma transformação isotérmica, quando a pressão aumenta, podemos afirmar que o trabalho é negativo e o volume é inversamente proporcional à pressão.”
Os termos: negativo / inversamente / pressão, estão listados corretamente e sequencialmente na alternativa b.
Questão 310
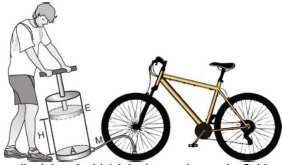
O pneu dianteiro da bicicleta tem volume de 2,4 L e possui, inicialmente, uma pressão interna de 0,3 atm. A pressão interna da bomba, quando o êmbolo (E) está todo puxado à altura (H) de 36 cm, é igual a 1 atm (pressão atmosférica normal).
Considere que, durante a calibragem, o volume do pneu permanece constante e que o processo é isotérmico, com temperatura ambiente de 27 ºC.
Nessas condições, para elevar a pressão do pneu até 6,3 atm, o número de repetições que o ciclista deverá fazer, movendo o êmbolo até o final do seu curso, é
- A) 20
- B) 50
- C) 80
- D) 95
A alternativa correta é letra A) 20
Gabarito: LETRA A.
Utilizando a equação de Clapeyron, vamos calcular o número de mols de ar que estão presentes no pneu na situação inicial (P_1 = 0,3 , atm, V_1 = 2,4 , L e T_1 = 27°C):
P_1 cdot V_1 = n_1 cdot R cdot T_1
Logo,
n_1 = dfrac { P_1 cdot V_1 } { R cdot T_1 }
Após a calibragem, o pneu passa a ter uma pressão P_2 = 6,3 , atm, mantendo o mesmo volume V_2 = V_1 = 2,4 , L e temperatura T_2 = T_1 = 27°C. Logo,
P_2 cdot V_2 = n_2 cdot R cdot T_2
n_2 = dfrac { P_2 cdot V_2 } { R cdot T_2 }
n_2 = dfrac { P_2 cdot V_1 } { R cdot T_1 }
Assim, a quantidade de ar que deve ser bombeada para o interior do pneu é dada por:
Delta n = n_2 - n_1
Delta n = dfrac { P_2 cdot V_1 } { R cdot T_1 } - dfrac { P_1 cdot V_1 } { R cdot T_1 }
Delta n = dfrac { left( P_2 - P_1 right) cdot V_1 } { R cdot T_1 }
De maneira análoga, podemos calcular a quantidade de ar que é bombeada após o movimento do êmbolo até o final do seu curso:
P_{bomba} cdot V_{bomba} = n_{bomba} cdot R cdot T_{bomba}
Como T_{bomba} = T_1, temos
n_{bomba} = dfrac { P_{bomba} cdot V_{bomba} }{ R cdot T_1 }
Então, podemos calcular o número de repetições que o ciclista deverá fazer da seguinte maneira:
x = dfrac { Delta n } { n_{bomba} }
Logo,
x = dfrac { dfrac { left( P_2 - P_1 right) cdot V_1 } { cancel { R cdot T_1 } } } { dfrac { P_{bomba} cdot V_{bomba} }{ cancel { R cdot T_1 } } }
x = dfrac { left( P_2 - P_1 right) cdot V_1 } { P_{bomba} cdot V_{bomba} }
O volume da bomba é dado por:
V_{bomba} = A cdot h = 20 , cm^2 cdot 36 , cm = 720 , cm^3
Como 1000 , cm^3 = 1 , L, temos que V_{bomba} = 0,72 , L. Assim, temos que
x = dfrac { left( 6,3 - 0,3 right) cdot 2,4 } { 1,0 cdot 0,72 }
x = 20
Portanto, a resposta correta é a alternativa (a).
