Questões Sobre Termologia - Física - concurso
Questão 321
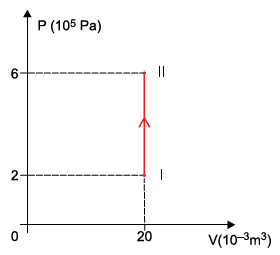
Adotando os valores R = 8 { large J over mol ⋅ K} para a constante universal dos gases e C_V = 12 { large J over mol ⋅ K} para o calor específico molar desse gás a volume constante, a quantidade de calor absorvida pelo gás para que sofresse tal transformação foi de
- A) 16 000 J.
- B) 14 000 J.
- C) 18 000 J.
- D) 12 000 J.
- E) 10 000 J.
A alternativa correta é letra D) 12 000 J.
Aplicando a equação dos gases perfeitos para o estado I, podemos encontrar a temperatura do gás neste estado.
P_I V_I = n R T_I
T_I = dfrac{P_I V_I}{n R}
T_I = dfrac{(2 times 10^5) cdot (20times 10^{-3})}{4 cdot 8}
T_I = dfrac{40 times 10^2}{32}
bbox[8px, border: 1px solid black]{color{black}{T_I = 125 ,K}}
Calculando a temperatura do gás no estado II, temos:
P_{II} V_{II} = n R T_{II}
T_{II} = dfrac{P_{II} V_{II}}{n R}
T_{II} = dfrac{(6 times 10^5) cdot (20times 10^{-3})}{4 cdot 8}
T_{II} = dfrac{120 times 10^2}{32}
bbox[8px, border: 1px solid black]{color{black}{T_{II} = 375 ,K}}
O calor específico molar a volume constante é a razão entre a quantidade de energia fornecida (Q), a variação de temperatura (Delta theta) sofrida pelo gás e o número de mols (n) para uma transformação a volume constante. Podemos verificar isso também analisando a unidade de (C_V) dado no enunciado.
begin{aligned} { [C_V] = dfrac{mbox{joule}}{mbox{mol} cdot mbox{Kelvin}}=dfrac{overbrace{mbox{joule}}^{Q}}{underbrace{mbox{mol}}_{n}cdot underbrace{mbox{Kelvin}}_{Delta theta}} \ , \ , \ [C_V] = dfrac{[Q]}{[n] cdot [Delta theta]} \ , \ , \ C_V = dfrac{Q}{n cdot Delta theta} \ , \ , \ bbox[8px, border: 1px solid black]{color{black}{Q = C_V cdot n cdot Delta theta}} } end{aligned}
Calculando a variação de temperatura:
begin{aligned} { Delta theta = T_{II}-T_{I} \ , \ , \ Delta theta = 375 - 125 \ , \ , \ bbox[8px, border: 1px solid black]{color{black}{Delta theta = 250,K }}} end{aligned}
Substituindo na expressão acima:
begin{aligned} { Q = C_V cdot n cdot Delta theta \ , \ , \ Q = 12 cdot 4 cdot 250 \ , \ , \ bbox[8px, border: 2px solid black]{color{#3498db}{Q = 12,000,J }}} end{aligned}
Portanto, a quantidade de calor absorvida pelo gás para que sofresse a transformação isovolumétrica entre os estados I e II foi de color{#3498db}{12 ,000 mbox{ J}}.
322) Um gás sofre uma expansão sem variar sua pressão. Nessa situação o gás sofre uma transformação chamada de:
- A) adiabática
- B) isotérmica
- C) isobárica
- D) isométrica
Resposta: C) isobárica
Quando um gás sofre uma expansão sem variar sua pressão, isso significa que a pressão do gás permanece constante durante todo o processo. Isso é característico de uma transformação isobárica.
Para entender melhor, vamos analisar as outras opções:
A) adiabática: uma transformação adiabática é aquela em que não há troca de calor entre o sistema e o meio externo. Isso não é o caso, pois não há menção a isso na questão.
B) isométrica: uma transformação isométrica é aquela em que o volume do sistema permanece constante. Isso não é o caso, pois a questão menciona uma expansão do gás.
D) isométrica: essa opção não faz sentido no contexto da questão, pois a expansão do gás implica uma mudança no volume do sistema.
Portanto, a resposta correta é C) isobárica.
323) Um cilindro de oxigênio medicinal com capacidade para 50 L deve ser transportado de um local à temperatura T1 = 7,0 °C para outro local a T2 = 27 °C. Considere que o oxigênio medicinal no interior do cilindro seja um gás ideal em equilíbrio térmico com a temperatura ambiente. A razão p1/p2 entre as pressões do gás nos dois locais é igual a
- A) 7/37
- B) 37/7
- C) 14/15
- D) 15/14
- E) 37/14
A alternativa correta é letra C) 14/15
Gabarito: LETRA C.
Utilizando a equação geral dos gases ideais, temos que:
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Como o volume do cilindro não varia, podemos escrever:
dfrac { P_1 cdot cancel { V_1 } } { T_1 } = dfrac { P_2 cdot cancel { V_1 } } { T_2 }
dfrac { P_1 } { P_2 } = dfrac { T_1 } { T_2 }
Logo,
dfrac { P_1 } { P_2 } = dfrac { 273 + 7 } { 273 + 27 }
dfrac { P_1 } { P_2 } = dfrac { 280 } { 300 }
dfrac { P_1 } { P_2 } = dfrac { 14 } { 15 }
Portanto, a resposta correta é a alternativa (c).
324) Joana foi passar as férias em La Paz, na Bolívia, que tem altitude de 4.061 metros acima do nível do mar.
- A) La Paz ter pressão atmosférica inferior à de Florianópolis.
- B) La Paz ter temperatura do ar superior à de Florianópolis.
- C) La Paz ter maior variabilidade climática do que Florianópolis.
- D) La Paz ter temperatura do ar inferior à de Florianópolis.
- E) La Paz ter pressão atmosférica superior à de Florianópolis.
Joana's experience of food taking longer to cook in La Paz, Bolivia, which is 4,061 meters above sea level, compared to her residence in Florianópolis, Brazil, can be explained by the fact that La Paz has lower atmospheric pressure than Florianópolis.
At higher altitudes, the atmospheric pressure decreases, which affects the boiling point of water. Since water boils at a lower temperature in low-pressure environments, it takes longer to cook food. This phenomenon is known as the "boiling-point elevation" effect.
In La Paz, the lower atmospheric pressure results in a lower boiling point of water, making it more challenging to cook food quickly. This is why Joana observed that it took longer for her food to cook in La Paz compared to Florianópolis.
Additionally, the altitude also affects the air density, which can impact the cooking process. At higher elevations, the air is thinner, and there is less oxygen available, which can slow down the cooking process.
Therefore, the correct answer is A) La Paz has lower atmospheric pressure than Florianópolis.
Explanation: The lower atmospheric pressure in La Paz is the primary reason for the longer cooking time. This is because the boiling point of water decreases with decreasing atmospheric pressure, requiring more time to cook food.
325) Um sistema isolado contendo um gás ideal é levado, de uma maneira reversível, de um estado inicial P0, V0, T0 para um estado final P,V,T por meio de dois caminhos possíveis. No caminho I, o gás sofre uma expansão isotérmica, seguida de uma compressão adiabática. No caminho II, o gás sofre uma compressão adiabática, seguida de uma expansão isotérmica. Ao analisar os caminhos I e II, é correto afirmar que:
- A) a variação de energia interna do caminho I é maior que a variação de energia interna do caminho II.
- B) a variação de entropia do caminho I é igual a variação de entropia do caminho II.
- C) a variação de energia interna do caminho I é menor que a variação de energia interna do caminho II.
- D) a variação de entropia do caminho I é menor que a variação de entropia do caminho II.
- E) a variação de entropia do caminho I é maior que a variação de entropia do caminho II.
A alternativa correta é letra B) a variação de entropia do caminho I é igual a variação de entropia do caminho II.
Vamos à análise das alternativas:
a) a variação de energia interna do caminho I é maior que a variação de energia interna do caminho II. Falso. A entropia e energia interna são funções de estado que só dependem dos estados inicial e final do gás, e não do caminho das mudanças de estado. Portanto, em ambos os casos, a variação de energia interna é a mesma.
b) a variação de entropia do caminho I é igual a variação de entropia do caminho II. Verdadeiro. Vide item A.
c) a variação de energia interna do caminho I é menor que a variação de energia interna do caminho II. Falso. Vide item A.
d) a variação de entropia do caminho I é menor que a variação de entropia do caminho II. Falso. Vide item B.
e) a variação de entropia do caminho I é maior que a variação de entropia do caminho II. Falso. Vide item B
Gabarito: B
326) A Teoria Cinética dos Gases se apoia em hipóteses fundamentais, relacionadas com as moléculas que compõem o gás e justificada por leis empíricas. Considerando os princípios da termodinâmica, qual das alternativas não é verdadeira para a Teoria Cinética dos Gases?
- A) As moléculas de um gás ideal se encontram em movimento desordenado, regido pelas leis da mecânica clássica newtoniana.
- B) Todas as moléculas do gás são independentes, interagem umas com as outras exclusivamente por meio das colisões, não sendo consideradas as forças de interação entre elas.
- C) As colisões que existirem do tipo moléculas-moléculas e as que ocorrerem entre as moléculas e as paredes do recipiente serão sempre colisões perfeitamente elásticas.
- D) A energia cinética dos gases permanece sempre constante e as moléculas têm movimento retilíneo uniformemente variado.
- E) As moléculas ocupam todo o volume do recipiente que as contém, e suas dimensões devem ser consideradas para ser possível calcular a força de interação entre elas.
A alternativa correta é letra E) As moléculas ocupam todo o volume do recipiente que as contém, e suas dimensões devem ser consideradas para ser possível calcular a força de interação entre elas.
Questão bem teórica pessoal.
Um macete para essa questão é desconsiderar os conceitos de mecânica clássica (cinemática, momento, conservação, etc...).
a) As moléculas de um gás ideal se encontram em movimento desordenado, regido pelas leis da mecânica clássica newtoniana.
ERRADO. Regem-se pela mecânica moderna.
b) Todas as moléculas do gás são independentes, interagem umas com as outras exclusivamente por meio das colisões, não sendo consideradas as forças de interação entre elas.
ERRADO. As forças de interação entre elas são consideradas.
c) As colisões que existirem do tipo moléculas-moléculas e as que ocorrerem entre as moléculas e as paredes do recipiente serão sempre colisões perfeitamente elásticas.
ERRADO. Não são perfeitamente elásticas.
d) A energia cinética dos gases permanece sempre constante e as moléculas têm movimento retilíneo uniformemente variado.
ERRADO. O movimento é caótico, podendo ter desvios. Além disso, a energia cinética pode variar visto não ser sempre elástica as colisões.
e) As moléculas ocupam todo o volume do recipiente que as contém, e suas dimensões devem ser consideradas para ser possível calcular a força de interação entre elas.
CORRETA. Se um vidro se quebra em um canto da sala contendo perfume em seu conteúdo, as moléculas tendem a ocupar a sala inteira. Essa ocupação em termos de dimensões é necessária para calcular a força de interação entre elas.
Gabarito: LETRA E.
327) A Lei de Stevin afirma que a diferença de pressão entre dois pontos em um líquido em repouso é igual ao produto da densidade do líquido d pela aceleração da gravidade g e pela altura da coluna do líquido h : p = p_0 + dgh. Já a Lei de Boyle-Mariotte afirma que a pressão de um gás p tende a diminuir à medida que o volume do recipiente V aumenta: p infty 1/V. Considere uma bexiga cheia de gás hélio tendo volume V_0 = 3000cm^3 a uma pressão atmosférica de p_0 = 100.000Pa. Ao se inseri1 · a bexiga a uma profundidade de 2 metros dentro de um açude, o volume da bexiga é:
- A) 1.200 cm3
- B) 1.500 cm3
- C) 2.500 cm3
- D) 3.000 cm3
- E) 3.600 cm3
A alternativa correta é letra C) 2.500 cm3
A questão forneceu as relações físicas necessárias.
Pessoal, a nova pressão será
p = 100.000 + 10^3 times 10 times 2 = 120.000 , Pa
Agora, temos que aplicar
P_0 V_0 = P V
100.000 times 3.000 = 120.000 times P
P = 2.500 , cm^3
Gabarito: LETRA C.
Questão 328
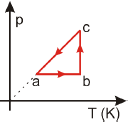
O gráfico que contém o diagrama p x V equivalente ao ciclo p x T é
- A)
- B)
- C)
- D)
- E)
Let's break down the problem step by step to understand why the correct answer is E).
The diagram shows a cycle abca in a p × T graph, which represents an ideal gas undergoing a cyclic process.
We know that the area under the curve in a p × V diagram represents the work done by the system. Since the problem provides a p × T diagram, we need to convert it to a p × V diagram to find the work done.
Let's analyze each option:
- A) The graph shows an isothermal expansion (ab) followed by an isochoric process (bc) and then an isothermal compression (ca). This process is not equivalent to the given p × T diagram.
- B) This graph shows an isobaric expansion (ab) followed by an isochoric process (bc) and then an isobaric compression (ca). This process is also not equivalent to the given p × T diagram.
- C) This graph shows an isothermal expansion (ab) followed by an isobaric process (bc) and then an isothermal compression (ca). This process is still not equivalent to the given p × T diagram.
- D) This graph shows an isobaric expansion (ab) followed by an isothermal process (bc) and then an isobaric compression (ca). This process is not equivalent to the given p × T diagram.
- E) This graph shows an isothermal expansion (ab) followed by an isochoric process (bc) and then an isothermal compression (ca). This process is equivalent to the given p × T diagram.
Therefore, the correct answer is E).
It's essential to note that the conversion from a p × T diagram to a p × V diagram is not a trivial task and requires a deep understanding of the ideal gas equation and the relationships between the variables.
In an ideal gas, the temperature is directly proportional to the product of pressure and volume (T ∝ pV). Using this relationship, we can convert the p × T diagram to a p × V diagram, which would show an isothermal expansion followed by an isochoric process and then an isothermal compression, as depicted in option E).
329) Considerando que um gás perfeito é definido como um gás a uma densidade suficientemente baixa, de modo que as forças intermoleculares e a energia associada possam ser desprezadas, julgue o próximo item.
- A) Certo
- B) Errado
A resposta certa é a letra B) Errado.
Para entender por que, vamos analisar o conceito de gás perfeito. Um gás perfeito é definido como um gás a uma densidade suficientemente baixa, de modo que as forças intermoleculares e a energia associada possam ser desprezadas. Isso significa que, em um gás perfeito, as moléculas se comportam de forma independente, sem interagir entre si.
A afirmação de que um gás perfeito, à determinada pressão, tem uma energia interna específica definida, qualquer que seja a temperatura, é errada. Isso porque a energia interna de um gás perfeito depende da temperatura. Segundo a equação de estado dos gases perfeitos, PV = nRT, a energia interna (U) é igual a (3/2)nRT, mostrando que a energia interna é diretamente proporcional à temperatura.
Portanto, a afirmação de que a energia interna específica de um gás perfeito é independente da temperatura é falsa, e a resposta certa é a letra B) Errado.
Questão 330
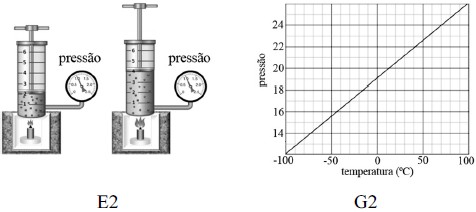
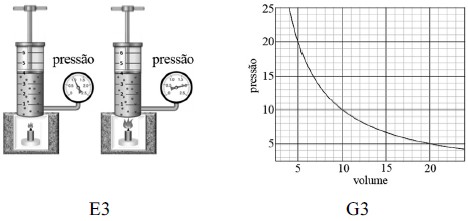
Anteriormente, as figuras E1, E2 e E3 são esboços de três experimentos realizados para o estudo do comportamento de um gás ideal sob a influência da pressão (P), do volume (V) e da temperatura (T). Os gráficos G1, G2 e G3 esboçam o comportamento da variação de P, V e T nesses experimentos; cada gráfico corresponde a um dos três experimentos e, em cada experimento, apenas uma grandeza P, V ou T é mantida constante.
Tendo como referência essas informações, assinale a opção correta.
Os pares (Ei, Gj), em que o experimento Ei corresponde ao gráfico Gj, no qual os índices i e j podem assumir os valores 1 ou 2, são
- A) (E1, G1), (E2, G2) e (E3, G3).
- B) (E1, G3), (E2, G2) e (E3, G1).
- C) (E1, G3), (E2, G1) e (E3, G2).
- D) (E1, G2), (E2, G3) e (E3, G1).
A alternativa correta é letra C) (E1, G3), (E2, G1) e (E3, G2).
Gabarito: LETRA C.
Primeiro, vamos analisar a figura E1:
É possível observar que há um aumento de volume e de pressão. Como apenas uma grandeza é mantida constante, podemos afirmar que o gás sofreu uma transformação isotérmica nesse experimento.
Da equação dos gases ideais, temos que:
dfrac { P cdot V } { T } = constante
Assim, a temperatura constante, temos:
dfrac { P cdot V } { cancel T } = constante
P = constante cdot dfrac 1V
Ou seja, a pressão é uma função racional do volume, como nos mostra a figura G3:
Assim, podemos afirmar que o primeiro par é (E1, G3).
Agora, vamos analisar a figura E2:
Note que a pressão é mantida constante, enquanto há um aumento de volume. Assim, temos:
dfrac {cancel P cdot V } { T } = constante
V = constante cdot T
Ou seja, o volume aumenta linearmente com a temperatura, como nos mostra a figura G1:
Logo, podemos afirmar que o segundo par é (E2, G1).
Finalmente, vamos analisar a figura E3:
Note que o volume é mantido constante, enquanto há um aumento de pressão. Assim, temos:
dfrac { P cdot cancel V } { T } = constante
P = constante cdot T
Ou seja, a pressão aumenta linearmente com a temperatura, como nos mostra a figura G2:
Então, podemos afirmar que o terceiro par é (E3, G2).
Portanto, a resposta correta é a alternativa (c).





