Questões Sobre Termologia - Física - concurso
331) Um recipiente de paredes rígidas e adiabáticas contém um gás em equilíbrio termodinâmico sob pressão p numa temperatura T. Devido a um defeito na válvula que controla a entrada e a saída do gás, ocorreu um pequeno escapamento. Reparando o defeito na válvula, verificou-se que o gás restante atingiu um novo estado de equilíbrio termodinâmico sob pressão 0,60.p na temperatura 0,80.T. Considere o gás ideal. Nesse caso, a seguinte fração do número de moléculas do gás inicialmente contido no recipiente vasou durante o escapamento:
- A)
large {1 over 8}.
- B)
large {1 over 6}.
- C)
large {1 over 5}.
- D)
large {1 over 4}.
- E)
large {1 over 3}.
A alternativa correta é letra D)
large {1 over 4}.
Pela equações geral dos gases ideais sabemos que:
frac{PV}{RT} = n
Onde n é o número de mols do gás. Após o vazamento o gás atinge novo equilíbrio termodinâmico com as seguintes variáveis:
frac{0,6PV}{R(0,8T)} = n'
Onde n' é o número de mols após o vazamento. Percebam que o volume ocupado pelo gás após a vazamento é o mesmo de antes do vazamento, pois o gás está contido num recipiente de paredes rígidas.
Então, para sabermos qual foi a fração do número de moléculas do gás inicialmente contido no recipiente que vasou durante o escapamento, podemos encontrar a razão frac{n'}{n}:
frac{n'}{n}=frac{frac{0,6PV}{R(0,8T)}}{frac{PV}{RT}}
frac{n'}{n}=frac{frac{0,6cancel{PV}}{cancel{R}(0,8cancel{T})}}{frac{cancel{PV}}{cancel{RT}}}
boxed{frac{n'}{n}=0,75}
Com base no resultado acima, concluímos que 25% (frac{1}{4}) da massa gás vazou durante o defeito. Portanto, o gabarito é a letra D.
Gabarito: D
Questão 332
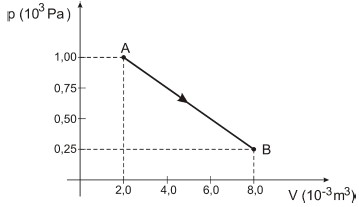
Durante esse processo, o gás recebeu uma quantidade de calor igual a
- A) 500 J.
- B) 400 J.
- C) 375 J.
- D) 300 J.
- E) 225 J.
A alternativa correta é letra C) 375 J.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
Sendo assim, vamos inicialmente calcular a variação da energia interna do gás.
A energia interna de um gás depende exclusivamente de sua temperatura. Calculando a temperatura do gás nos dois estados através da equação de Clapeyron, temos:
pcdot V=ncdot Rcdot T ,,, implies ,,, T=dfrac{pcdot V}{ncdot R}
T_A = dfrac{p_A cdot V_A}{ncdot R}
T_A = dfrac{(1times 10^3) cdot (2 times 10^{-3})}{ncdot R}
T_A = dfrac{2}{ncdot R}
T_B = dfrac{p_B cdot V_B}{ncdot R}
T_B = dfrac{(0,25times 10^3) cdot (8 times 10^{-3})}{ncdot R}
T_B = dfrac{2}{ncdot R}
Podemos notar que as temperaturas do gás nos estados A e B são iguais (T_A=T_B), como a energia interna depende apenas da temperatura, a energia interna no estado A é a mesma que no estado B. Logo podemos afirmar que a variação da energia interna sofrida pelo gás na transformação entre A e B é nula.
Delta U = 0
O trabalho realizado pelo gás pode ser obtido através da área abaixo da curva do gráfico p-V. A figura formada é um trapézio, calculando a área do trapézio indicado, temos:
tau = mbox{Área} ;;;;; mbox{(numericamente)}
tau= dfrac{(B+b)h}{2}
tau = dfrac{(1 times 10^3+0,25 times 10^3) (8times 10^{-3}-2times 10^{-3})}{2}
tau = dfrac{(1,25 times 10^3)( 6times 10^{-3})}{2}= dfrac{(1,25 times bcancel{10^3})( cancelto{3}{6}times bcancel{10^{-3}})}{cancel{2}}
tau=1,25 times 3
tau=3,75, J
Retornando à equação do primeiro princípio da termodinâmica, temos:
Q = tau + Delta U
Q= 3,75+0
boxed{Q=3,75,J}
Vejamos as alternativas:
a) 500 J.
b) 400 J.
c) 375 J. Gabarito da Banca.
d) 300 J.
e) 225 J.
Analisando alternativas, verificamos que nossa solução não encontra correspondência juntos alternativas apresentadas. Acreditamos que o gabarito da banca (Letra C) possa ter saído com erro ou o examinador cometeu algum erro na escala do gráfico apresentado no enunciado.
Gabarito da Banca: C
Gabarito do professor. Anulada
333) Em uma transformação isobárica, a pressão do gás é constante e sua energia interna aumenta se a diferença entre o calor e o trabalho envolvidos no processo for:
- A) nula
- B) positiva
- C) negativa
- D) maior que 1
A alternativa correta é a letra B) positiva
Para entender por que a alternativa correta é a letra B) positiva, vamos analisar a transformação isobárica. Nessa transformação, a pressão do gás é constante e sua energia interna aumenta. Isso significa que o gás está recebendo calor ou realizando trabalho sobre o ambiente.
De acordo com a Primeira Lei da Termodinâmica, a variação da energia interna (ΔU) de um sistema é igual à soma do calor (Q) adicionado ao sistema e do trabalho (W) realizado sobre o sistema:
ΔU = Q - W
Como a transformação é isobárica, a pressão é constante. Isso significa que o volume do gás varia durante a transformação. Portanto, o trabalho realizado sobre o sistema (W) é diferente de zero.
Como a energia interna do gás aumenta durante a transformação, sabemos que ΔU é positiva. Além disso, como o trabalho realizado sobre o sistema (W) é diferente de zero, sabemos que a diferença entre o calor adicionado ao sistema (Q) e o trabalho realizado sobre o sistema (W) também é positiva.
Portanto, a alternativa correta é a letra B) positiva, pois a diferença entre o calor e o trabalho envolvidos no processo é positiva.
334) Um mol de gás ideal sofre uma transformação isotérmica, na qual seu volume passa de 10 L (estado inicial: 1) para 25 L (estado final: 2).
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra D)
Gabarito: LETRA D.
De acordo com a lei dos gases ideais, podemos escrever:
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Para uma transformação isotérmica (T_2 = T_1), temos
dfrac { P_1 cdot V_1 } { cancel {T_1 } }= dfrac { P_2 cdot V_2 } { cancel { T_1 } }
P_2 = dfrac { V_1 } { V_2} cdot P_1
Substituindo os valores do enunciado, temos
P_2 = dfrac { 10 } { 25 } cdot P_1
P_2 = dfrac { 2 } { 5 } cdot P_1
P_2 = 0,4 cdot P_1
Da equação acima, podemos afirmar que P_2 lt P_1, ou seja, a pressão do gás DIMINUIU durante o processo. Portanto, as alternativas (a) e (c) estão incorretas, pois a pressão no estado final 2 é maior que no estado final 1 nos gráficos dessas alternativas ilustram.
Sabemos que a entalpia é dada pela função de estado:
H = U + PV
Onde U é a energia interna, P a pressão e V o volume. Lembrando que PV = nRT, a equação acima se torna:
H = U + nRT
Então, podemos escrever:
Delta H = Delta U + nR Delta T
Como o processo é isotérmico, temos que Delta U = 0 e Delta T = 0. Então, temos que
Delta H = 0 + nR cdot 0.
Delta H = 0
Ou seja, a entalpia não varia durante a transformação. Note que o único gráfico em que a entalpia não varia, e que a pressão diminui, é a alternativa (d).
Portanto, a resposta correta é a alternativa (d).
Questão 335
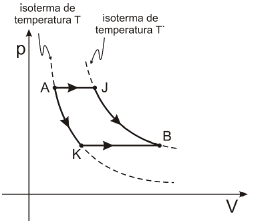
Quando o gás evolui através do processo AJB, recebe uma quantidade de calor Q1; já através do processo AKB, recebe uma quantidade de calor Q2.
Essas quantidades de calor são tais que
- A) Q1 < Q2.
- B) Q1 ≤ Q2.
- C) Q1 = Q2.
- D) Q1 ≥ Q2.
- E) Q1 > Q2.
A alternativa correta é letra E) Q1 > Q2.
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho W realizado pelo gás mais a variação da energia interna (Delta U) sofrida por ele.
Q=W + Delta U
Q=- PcdotDelta{V} + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Calculando a temperatura do gás nos dois estados através da equação de Clapeyron, teremos:
frac{pcdot V}{T}=ncdot R ,,, implies ,,, T=dfrac{pcdot V}{ncdot R}
Vejamos o que acontece nos processos:
1. AJB.
De A para J, ocorre uma transformação isobárica com aumento de volume (expansão) do sistema. Então, podemos afirmar que parte a energia Q_1 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema e a outra parte na elevação da energia interna do gás e consequentemente sua temperatura.
De J para B, ocorre aumento de volume e diminuição de pressão e a temperatura permanece constante. Então, não há alteração da energia interna do gás de J para B. Portanto:
Q_1=- P_1cdotDelta{V_1} +W_{JB}+ Delta U tag 1
Onde W_{JB} é o trabalho de J para B, representado pela área abaixo da curva.
2. AKB.
De A para K, ocorre uma transformação térmica com aumento de volume e diminuição de pressão. Então, podemos afirmar que parte a energia Q_2 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema.
De K para B, ocorre novamente uma transformação isobárica com aumento de volume (expansão) do sistema. Então, podemos afirmar que a outra parte a energia Q_2 recebida pelo gás foi utilizada para realizar trabalho sobre o sistema e a outra parte na elevação da energia interna do gás e consequentemente sua temperatura. Portanto:
Q_2=- P_2cdotDelta{V_2} +W_{AK}+ Delta Utag 2
Onde W_{AK} é o trabalho de A para K, representado pela área abaixo da curva.
Obs: Nota-se que as áreas W_{AK} e W_{JB} são muito parecidas. Então, podemos considerá-las iguais. Comparando as equações (1) e (2), percebemos que a maior diferença entre as energias Q_1 e Q_2 se dá no produto PcdotDelta{V}. Logo, como a pressão P_1 > P_2, então Q_1 > Q_2.
Gabarito: E
Questão 336

Fonte: Canto e Canto, 2019
A variação de volume presente na Fig. B deve-se
- A) à variação da temperatura, visto que, em temperaturas mais baixas, ocorre a diminuição e, em temperaturas mais altas, o aumento do volume do ar dentro do balão.
- B) à variação da temperatura, visto que, em temperaturas mais baixas, ocorre o aumento e, em temperaturas mais altas, a diminuição do volume do ar dentro do balão.
- C) a outros fatores, considerando que a temperatura não tem relação com a expansão do volume do ar presente nos balões.
- D) ao tamanho do balão, pois a temperatura não interfere na variação do volume do ar dentro do balão.
- E) à forma como o ar foi colocado dentro do balão e não à diferença de temperatura.
Observar o comportamento do ar quando submetido a condições diferentes de temperatura propicia o desenvolvimento de ideias científicas, como a possibilidade de entender melhor o mundo ao seu redor. A esse respeito, observe as figuras A e B, que ilustram dois balões de borracha preenchidos com ar, inicialmente de mesmo volume (Fig. A), os quais são colocados em contato prolongado (Fig. B), um com água gelada e outro com água morna, obtida do chuveiro.

Fonte: Canto e Canto, 2019
A variação de volume presente na Fig. B deve-se
- A) à variação da temperatura, visto que, em temperaturas mais baixas, ocorre a diminuição e, em temperaturas mais altas, o aumento do volume do ar dentro do balão.
- B) à variação da temperatura, visto que, em temperaturas mais baixas, ocorre o aumento e, em temperaturas mais altas, a diminuição do volume do ar dentro do balão.
- C) a outros fatores, considerando que a temperatura não tem relação com a expansão do volume do ar presente nos balões.
- D) ao tamanho do balão, pois a temperatura não interfere na variação do volume do ar dentro do balão.
- E) à forma como o ar foi colocado dentro do balão e não à diferença de temperatura.
Explique a resposta sabendo que a alternativa correta desta questão é:
A) à variação da temperatura, visto que, em temperaturas mais baixas, ocorre a diminuição e, em temperaturas mais altas, o aumento do volume do ar dentro do balão.
Essa resposta é correta pois, quando o balão de borracha é colocado em contato com a água gelada, o ar dentro do balão se contrai devido à diminuição da temperatura, o que causa a redução do volume do balão. Já quando o balão é colocado em contato com a água morna, o ar dentro do balão se expande devido ao aumento da temperatura, o que causa o aumento do volume do balão. Portanto, a variação de volume do balão está diretamente relacionada à variação da temperatura.
337)
- A) P_0 left( { large V_0 over V} right)^{ gamma}
- B) A P_0 left( { large V_0 over v} right)^{ gamma +1}
- C) A P_0 left( { large V_0 over v} right)
- D) A P_0 left( { large V_0 over v} right)^{ gamma}
- E) A,P_0
A alternativa correta é letra D) A P_0 left( { large V_0 over v} right)^{ gamma}
Gabarito: LETRA D.
Como as paredes são adiabáticas, não ocorre troca de calor durante a expansão do gás. Assim, de acordo com a lei geral dos gases ideais, podemos escrever a seguinte equação:
PV^{gamma} = mathrm{constante}
Então, sendo P a pressão quando o gás tiver expandido até o volume V, temos que
P_0 {V_0}^{gamma} = P V^{gamma}
Logo,
P = dfrac { P_0 {V_0}^{gamma} }{ V^{gamma} }
P = P_0 dfrac { {V_0}^{gamma} }{ V^{gamma} }
P = P_0 left( dfrac { V_0 } { V } right)^{gamma}
Sendo F a força resultante sobre o êmbolo de área A, a equação acima se torna
dfrac FA = P_0 left( dfrac { V_0 } { V } right)^{gamma}
F = A P_0 left( dfrac { V_0 } { V } right)^{gamma}
Portanto, a resposta correta é a alternativa (d).
Questão 338
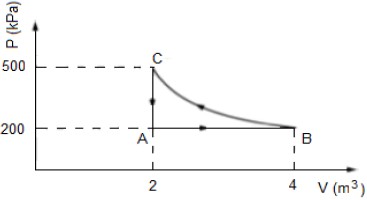
- A) 400 kJ.
- B) 800 kJ.
- C) - 300 kJ.
- D) 0.
- E) - 500 kJ.
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás e no caso da nossa questão, no ciclo ABC, ocorre uma variação da pressão e do volume. Portanto, o trabalho realizado pelo gás equivale à área da figura ABC. Entretanto, percebam que essa figura se assemelha a um triângulo. Entretanto, ela não é um triângulo, pois a curva BC não é uma linha reta.
Caso contrário, o trabalho do sistema seria:
W = - frac{(500-200)cdot(4-2)}{2}
boxed{W = - 300,J}
Acreditamos que o motivo da ANULAÇÃO da questão foi o fato dela deixar muito indefinido o critério para aproximação da área da figura.
Gabarito: ANULADA
339) Para qual dos seguintes processos termodinâmicos o aumento da energia interna de um gás ideal é igual ao calor adicionado ao gás?
- A) Temperatura constante.
- B) Volume constante.
- C) Pressão constante.
- D) Adiabático.
- E) Cíclico.
A alternativa correta é letra B) Volume constante.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
Por outro lado, os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás. E se não houver variação de volume do sistema onde se encontra o gás, então não haverá trabalho realizado sob o gás e, portanto, toda a energia recebida pelo gás será usada na elevação de sua energia interna Delta U.
Portanto, a situação apresentada no enunciado só poderá ocorrer em processos termodinâmicos a volume constante.
Gabarito: B
340) A famosa constante universal dos gases, R, utilizada na equação dos gases ideais PV=nRT pode ser expressa em várias unidades, sendo a mais conhecida R = 0,082 [atm*L/(mol*K)]. O sistema internacional de unidades expressa R com outras unidades [J/(mol*K)], sendo [J] = Joules e [K] = Kelvin. Sabendo que 1 atm = 101325 Pascal e que o sistema internacional de medidas usa m3 e não litros, qual o valor de R no sistema internacional de unidades?
- A) 62,3
- B) 1,99
- C) 8,31
- D) 8,31 * 10^7
- E) 2,33
Resposta: C) 8,31 J/(mol·K)
Para encontrar o valor da constante universal dos gases, R, no sistema internacional de unidades, precisamos converter a unidade atm para o sistema internacional de unidades. Sabemos que 1 atm é igual a 101325 Pascals. Além disso, a equação dos gases ideais é PV = nRT, onde R é a constante universal dos gases.
Para converter a unidade atm para o sistema internacional de unidades, podemos reescrever a equação como:
$$R = frac{0,082 frac{L cdot atm}{mol cdot K}}{1 frac{mol}{L}} = frac{0,082 frac{L cdot atm}{mol cdot K}}{frac{1}{22,4} frac{m^3}{L}}$$
Substituindo o valor de 1 atm em Pascals, obtemos:
$$R = frac{0,082 frac{L cdot atm}{mol cdot K}}{frac{1}{22,4} frac{m^3}{L}} = frac{0,082 frac{L cdot 101325 Pa}{mol cdot K}}{frac{1}{22,4} frac{m^3}{L}}$$
Essa equação pode ser simplificada para:
$$R = 8,31 frac{J}{mol cdot K}$$
Portanto, o valor da constante universal dos gases, R, no sistema internacional de unidades é 8,31 J/(mol·K).





