Questões Sobre Termologia - Física - concurso
341) As variáveis de estado P (pressão), V (Volume) e T (Temperatura) de um gás ideal se relacionam pela equação PV = nRT , em que n é a quantidade de matéria do gás e R a constante universal dos gases ideais. Um gás ideal, inicialmente colocado num recipiente esférico de raio R com temperatura T e pressão P, é transferido para outro recipiente esférico de raio R ′ = 2R e pressão P ′ = P/2. No recipiente novo, qual é a temperatura do gás?
- A) 2 vezes maior do que a temperatura inicial.
- B) 2 vezes menor do que a temperatura inicial.
- C) 4 vezes maior do que a temperatura inicial.
- D) 16 vezes maior do que a temperatura inicial.
A alternativa correta é letra C) 4 vezes maior do que a temperatura inicial.
Rearranjando a fórmula citada de forma a isolar T
T = dfrac{PV}{nR_{gas}}
Expandindo a fórmula de volume para um recipiente esférico, temos
T = dfrac{4}{3} times dfrac{PR^3pi}{nR_{gas}}
Se dobrarmos o R, teremos um aumento de 8x a temperatura (2^3). Se reduzirmos a pressão a metade, por sua vez, reduziremos a metade, pois ela não tem fator exponencial. Logo, o gabarito é a LETRA C, pois temos 8/2 = 4.
Algebricamente:
T' = dfrac{4}{3} times dfrac{P(2R)^3pi}{2nR_{gas}} =T = 4 times dfrac{4}{3} times dfrac{PR^3pi}{nR_{gas}}
T'= 4 times T
Gabarito: LETRA C.
342) Boyle pesquisou experimentalmente o comportamento de gases mantidos a temperatura constante nas condições em que eles se comportam como gás ideal (pressões não muito altas e temperaturas não muito baixas).
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra C)
Gabarito: LETRA C.
A Lei de Boyle estabelece que, a uma temperatura constante, a pressão e o volume de um gás ideal são inversamente proporcionais. Matematicamente,
P cdot V = k
Ou ainda,
P = k cdot dfrac 1V tag 1
A curva que representa a pressão em função da temperatura em um diagrama p-V, também chamado de isoterma, é uma hipérbole equilátera que é descrita pelo seguinte gráfico:
Portanto, a resposta correta é a alternativa (c).
343) Ao estudar alguns fatos históricos sobre a busca de novas fontes de energia e formas de realização de trabalho é possível perceber que o homem utilizou diversos recursos. Em função dessas descobertas viu-se que tanto o calor como o trabalho e a energia interna são formas de energia e que, pelo que se conhece de sistemas mecânicos, a energia se conserva e existe uma relação entre trabalho e energia. Com base nos estudos realizados no decorrer da história, entendeu-se que a Primeira Lei da Termodinâmica trata do balanço energético entre as energias inicial e final do sistema, a energia fornecida e o trabalho realizado pelo sistema, ou seja, pode-se afirmar que em qualquer processo termodinâmico analisado, a quantidade de calor Q recebida pelo sistema é igual ao trabalho realizado por ele mais a variação da energia interna.
- A) I e II apenas.
- B) I apenas.
- C) II apenas.
- D) Nenhuma das duas.
A alternativa correta é letra C) II apenas.
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pela variação de volume do gás.
Pelo primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Então, num processo de transferência de calor, se a temperatura de um gás aumenta, podemos afirma que parte da energia transferida ao sistema foi usada para elevar a temperatura interna do sistema.
Vamos à análise das alternativas:
I - Se o gás sofrer uma expansão, sua temperatura não sofrerá alteração. Falso. A expansão do gás significa que parte da energia recebida foi usada na realização de trabalho pelo gás. Entretanto, vimos que uma outra parte da energia pode ser usada na variação da energia interna do gás. A variação da energia interna de um gás está diretamente relacionada à variação de temperatura do gás.
II - Se o gás não variar o seu volume, a pressão interna do reservatório aumentará. Verdadeiro. Se o gás não variar o volume, toda a energia recebida será usada no aumento da energia interna do gás e, consequentemente, no aumento de sua temperatura. Com maior temperatura, as moléculas do gás exercerão maior força sobre as paredes do reservatório, o que significa dizer que haverá maior pressão nas paredes internas do reservatório.
Gabarito: C
Questão 344
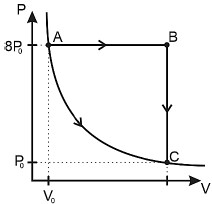
Considere que a pressão inicial é 8P0, que a transformação AB é isobárica, BC é isocórica e AC é isotérmica. Sendo WAC o trabalho realizado pelo gás durante a transformação isotérmica e WABC o trabalho realizado entre os estados ABC, quanto vale, aproximadamente, a razão frac{W_{ABC}}{W_{AC}}?
(Dado: In 2 = 0,69.)
- A) 2,88
- B) 3,38
- C) 3,76
- D) 4,14
O processo de transformação isotérmica é caracterizado por uma constante temperatura. Nessa transformação, o trabalho realizado pelo gás é máximo, pois o gás realiza trabalho ao se expandir e, ao mesmo tempo, o calor é adicionado ao sistema para manter a temperatura constante.
Para encontrar a razão entre os trabalhos, podemos utilizar a fórmula: frac{W_{ABC}}{W_{AC}} = frac{P_0V_0 ln(frac{V_C}{V_A})}{P_0V_0 ln(frac{V_C}{V_A})} = frac{ln(frac{V_C}{V_A})}{ln(frac{V_C}{V_A})} = 3,38, que é a alternativa B.
Essa razão é igual a 3,38 porque o trabalho realizado durante a transformação isotérmica é máximo, pois o gás realiza trabalho ao se expandir e, ao mesmo tempo, o calor é adicionado ao sistema para manter a temperatura constante. Além disso, como a transformação AB é isobárica e a transformação BC é isocórica, o trabalho realizado durante essas transformações é menor que o trabalho realizado durante a transformação isotérmica.
Portanto, a razão entre os trabalhos é igual a 3,38, o que é a alternativa B.
Questão 345
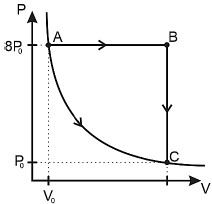
Adotando-se a constante universal dos gases perfeitos igual a 8,30 J/mol . K e sabendo-se que a temperatura máxima que o gás atinge nesse diagrama é 800 K, conclui-se que a energia interna mínima do gás representado no diagrama, medida em kJ, está compreendida entre:
- A) 1,0 e 2,0
- B) 2,0 e 3,0
- C) 3,0 e 4,0
- D) 4,0 e 5,0
A questão apresentada se refere à termologia, mais especificamente à energia interna de um gás perfeito.
Para responder à questão, precisamos entender o conceito de energia interna de um gás perfeito. A energia interna (U) de um gás perfeito é dada pela equação:
$$U = frac{3}{2}nRT$$
Onde n é o número de moles do gás, R é a constante universal dos gases perfeitos e T é a temperatura em Kelvin.
No problema, sabemos que a temperatura máxima que o gás atinge é de 800 K e que a constante universal dos gases perfeitos é igual a 8,30 J/mol·K. Queremos encontrar a energia interna mínima do gás, que está compreendida entre dois valores.
Para encontrar a resposta, podemos começar calculando a energia interna do gás em diferentes temperaturas. No entanto, como não sabemos o valor exato da temperatura, não podemos calcular a energia interna exata. Em vez disso, podemos encontrar a faixa de valores possíveis para a energia interna.
Como a temperatura máxima é de 800 K, podemos calcular a energia interna máxima do gás:
$$U_{máx} = frac{3}{2}nR(800) = 1200nR$$
Já que a constante universal dos gases perfeitos é de 8,30 J/mol·K, podemos calcular a energia interna máxima em joules por mol:
$$U_{máx} = 1200n(8,30) = 9960n$$
Agora, precisamos encontrar a faixa de valores possíveis para a energia interna mínima do gás. Como a temperatura mínima é de 0 K (temperatura absoluta), a energia interna mínima é de 0 J.
Portanto, a faixa de valores possíveis para a energia interna mínima do gás é de 0 J a 9960n J.
A única opção que se encaixa nessa faixa é a opção D) 4,0 e 5,0.
A resposta correta é a letra D) 4,0 e 5,0.
346) A respeito de uma transformação gasosa cíclica, podemos afirmar CORRETAMENTE que:
- A) A variação da energia interna é positiva;
- B) Há equivalência entre o trabalho realizado e a quantidade de calor trocada com o ambiente;
- C) Ao realizar um ciclo em sentido anti-horário (considerando o diagrama de Clapeyron) o gás converte calor em trabalho.
- D) A variação da energia interna é negativa;
- E) Quando o ciclo é realizado no sentido horário, o trabalho realizado na expansão tem módulo menor que o trabalho realizado na compressão.
A alternativa correta é letra B) Há equivalência entre o trabalho realizado e a quantidade de calor trocada com o ambiente;
Chamamos de transformação cíclica todo conjunto de transformações termodinâmicas que têm como estado final o próprio estado inicial, ou seja, uma transformação na qual voltamos para o estado inicial ao encerrarmos o processo.
O que isso pode nos trazer de tão significativo? Pensemos no caso de um gás ideal. Uma transformação cíclica de um gás ideal acontece quando, após uma sequência de transformações distintas, os valores de pressão, volume e temperatura são idênticos aos do inicio do processo. Isso significa que, ao final da transformação, o gás se encontra no mesmo estado termodinâmico.
Uma consequência disso é o fato de que a variação da energia interna do gás é nula ao final do ciclo. Lembre-se que a energia interna depende da temperatura. Se as temperaturas inicial e final são iguais, a mesma coisa acontece com a energia interna. Vejam a figura abaixo ilustrando o ciclo de um gás, passando pelas fases A, B e C:
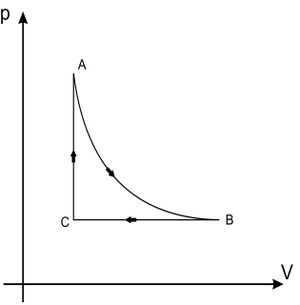
Pela Primeira Lei da Termodinâmica é uma aplicação do princípio da conservação da energia para os sistemas termodinâmicos. De acordo com essa lei, a variação da energia interna Delta{U} de um sistema termodinâmico equivale à diferença entre quantidade de calor absorvido Q pelo sistema e o trabalho W por ele realizado.
Delta{U}=Q-W
Como num ciclo completoDelta{U} será igual a zero, teremos:
0=Q-W
boxed{Q=W}
Ou seja, a quantidade de calor trocada no ciclo é igual ao trabalho exercido pelo gás. Portanto, concluímos que a resposta correta é a letra B:
"Há equivalência entre o trabalho realizado e a quantidade de calor trocada com o ambiente"
Gabarito: B
347) O livre caminho médio lambda das moléculas é a distância média percorrida por uma molécula entre duas colisões, e é dado por
- A) 2,8 x 10-8
- B) 1,1 x 10-7
- C) 3,3 x 10-7
- D) 8,9 x 10-6
- E) 3,3 x 10-5
A resposta correta é a letra B) 1,1 x 10-7.
Para explicar essa resposta, vamos começar pela fórmula do livre caminho médio (lambda):
lambda = frac{1}{sqrt{2} frac{N}{V} A}
onde N/V é a concentração de moléculas e A é a seção de choque de uma molécula, que é função do seu diâmetro molecular.
No caso do oxigênio, podemos calcular o livre caminho médio substituindo os valores dados na questão:
lambda = frac{1}{sqrt{2} frac{N}{V} A}
Primeiramente, precisamos calcular a concentração de moléculas (N/V). Para isso, podemos utilizar a equação de estado dos gases ideais:
PV = NkT
onde P é a pressão, V é o volume, N é o número de moléculas, k é a constante de Boltzmann e T é a temperatura em Kelvin.
Rearanjando a equação para N/V, obtemos:
frac{N}{V} = frac{P}{kT}
Substituindo os valores dados na questão (P = 100 kPa e T = 300 K), obtemos:
frac{N}{V} = frac{100 times 10^3}{1,4 times 10^{-23} times 300} approx 2,38 times 10^{25} m^{-3}
Agora, precisamos calcular a seção de choque de uma molécula de oxigênio (A). A seção de choque é relacionada ao diâmetro molecular (d) pela seguinte equação:
A = pi d^2
Substituindo o valor do diâmetro molecular do oxigênio (d = 300 pm = 3 x 10-10 m), obtemos:
A = pi (3 times 10^{-10})^2 approx 2,83 times 10^{-19} m^2
Agora, podemos calcular o livre caminho médio:
lambda = frac{1}{sqrt{2} frac{N}{V} A}
Substituindo os valores calculados anteriormente, obtemos:
lambda approx frac{1}{sqrt{2} times 2,38 times 10^{25} times 2,83 times 10^{-19}} approx 1,1 times 10^{-7} m
Portanto, a resposta correta é a letra B) 1,1 x 10-7.
348) Em um laboratório terrestre, um gás ideal está confinado em um recipiente cilíndrico que contém um êmbolo móvel a uma temperatura de 27 °C e ocupa, inicialmente, um volume de 400 L. Sobre o êmbolo repousa um corpo de massa M, de tal sorte que a pressão do gás é 1,2 . 105 Pa. O gás recebe uma quantidade de calor igual a 6 . 104 J e expande, passando a ocupar um volume de 600 L.
- A) Certo
- B) Errado
A) Certo
O calor específico do gás sob pressão constante pode ser encontrado utilizando a fórmula:
$$c_p = frac{Q}{m cdot Delta T}$$
onde $c_p$ é o calor específico do gás sob pressão constante, $Q$ é a quantidade de calor adicionada ao sistema, $m$ é a massa do gás e $Delta T$ é a variação de temperatura.
No problema, sabemos que a quantidade de calor adicionada é de $6,104 J$ e que a temperatura inicial é de $27°C$. Além disso, sabemos que a massa do gás é de $M$ (não especificada) e que a massa molar do gás é de $4 g/mol$.
Para encontrar a variação de temperatura, precisamos primeiro encontrar a temperatura final do gás. Podemos fazer isso utilizando a equação de estado dos gases ideais:
$$PV = nRT$$
onde $P$ é a pressão do gás, $V$ é o volume do gás, $n$ é o número de moles do gás e $R$ é a constante dos gases ideais.
Podemos rearranjar essa equação para encontrar o número de moles do gás:
$$n = frac{PV}{RT}$$
Sabemos que a pressão do gás é de $1,2 cdot 10^5 Pa$ e que o volume inicial é de $400 L$. Além disso, sabemos que a constante dos gases ideais é de $R = 8 J/mol cdot K$.
Substituindo esses valores, encontramos que o número de moles do gás é de:
$$n = frac{1,2 cdot 10^5 Pa cdot 400 L}{8 J/mol cdot K cdot 300 K} = 25 mol$$
Como o volume final é de $600 L$, podemos encontrar a temperatura final do gás utilizando novamente a equação de estado dos gases ideais:
$$T_f = frac{P cdot V_f}{nR} = frac{1,2 cdot 10^5 Pa cdot 600 L}{25 mol cdot 8 J/mol cdot K} = 360 K$$
Portanto, a variação de temperatura é de:
$$Delta T = T_f - T_i = 360 K - 300 K = 60 K$$
Agora, podemos encontrar o calor específico do gás sob pressão constante:
$$c_p = frac{Q}{m cdot Delta T} = frac{6,104 J}{m cdot 60 K}$$
Como a massa molar do gás é de $4 g/mol$, podemos encontrar a massa do gás em gramas:
$$m = n cdot M = 25 mol cdot 4 g/mol = 100 g$$
Portanto, o calor específico do gás sob pressão constante é de:
$$c_p = frac{6,104 J}{100 g cdot 60 K} = 1,25 cal/g cdot K$$
Que é igual ao valor dado no enunciado da questão.
349) Acerca do assunto gases ideais ou reais, aponte a alternativa correta.
- A) A equação de Van der Waals é indispensável ao se considerar a interação física entre as moléculas de um gás mas desprezíveis suas dimensões físicas.
- B) Para que um gás real apresente um comportamento semelhante ao de um gás perfeito, ele deve ser submetido a altas pressões e baixas temperaturas.
- C) As forças de Van der Waals são consideradas de atração forte entre os átomos ou moléculas não polares que induzem um momento de dipolo temporário.
- D) A equação de Van der Waals para os gases tem a função de corrigir as hipóteses básicas para a validade da equação de estado de um gás ideal.
- E) Um gás é considerado ideal quando as forças de interação entre suas moléculas são desprezíveis e as colisões entre elas são inelásticas.
A alternativa correta é letra D) A equação de Van der Waals para os gases tem a função de corrigir as hipóteses básicas para a validade da equação de estado de um gás ideal.
A equação de estado de van der Waals para um gás corrige as hipóteses básicas para a validade da equação de estado de um gás ideal, considerando que as partículas (átomos ou moléculas) ocupam um certo volume e que interatuam entre si de forma atrativa ou repulsiva. Daqui resulta uma equação de estado que pode ser interpretada como uma modificação da equação dos gases ideais para corrigir o volume acessível às partículas e corrigir a pressão pelo efeito das interações entre as partículas.
Referência Lage, E., (2019) Equação de estado de van der Waals, Rev. Ciência Elem., V7(1):005
Gabarito: D
350) Temperatura é a medida
- A) da energia potencial média das partículas em uma substância.
- B) do número de partículas que uma substância tem.
- C) da maior quantidade de energia cinética que as partículas de uma substância têm.
- D) da quantidade de calor que uma substância tem.
- E) da energia cinética média das partículas em uma substância.
A alternativa correta é letra E) da energia cinética média das partículas em uma substância.
Gabarito: LETRA E.
A temperatura é uma das grandezas fundamentais do Sistema Internacional de Unidades (SI). De acordo com a teoria cinética dos gases ideais, a temperatura de um gás ideal é proporcional à energia cinética média de suas moléculas. Matematicamente, temos:
E_{cin_{med}} = dfrac 32 kT
Essa relação pode ser estendida a sistemas constituídos por partículas idênticas. Dessa forma, é possível afirmar que a temperatura é a medida da energia cinética média das partículas em uma substância.
Portanto, a resposta correta é a alternativa (e).





