Questões Sobre Termologia - Física - concurso
351) Uma amostra de um gás é mantida em um recipiente não rígido, deformável. Se a pressão e a temperatura do gás forem mantidas constantes e o número de moléculas do gás for dobrado, o volume por ele ocupado:
- A) aumenta para o dobro.
- B) aumenta por um fator de quatro.
- C) permanece o mesmo.
- D) diminui para um quarto do volume original.
- E) diminui para metade do volume original.
A alternativa correta é letra A) aumenta para o dobro.
Gabarito: LETRA A.
Para gases ideais, podemos escrever a equação de Clapeyron:
PV = nRT
Logo,
V = dfrac { nRT } { P }
Se a pressão e a temperatura do gás forem mantidas constantes e o número de moléculas do gás for dobrado, a equação acima se torna:
V' = dfrac { left( 2 n right) RT } { P }
V' = dfrac { 2 cdot nRT } { P }
V' = 2 cdot dfrac { nRT } { P }
V' = 2 cdot V
Ou seja, o volume por ele ocupado aumenta para o dobro.
Portanto, a resposta correta é a alternativa (a).
Questão 352
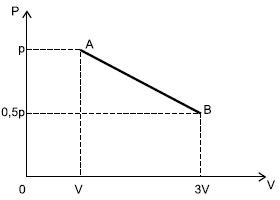
Ao final do processo, o gás terá realizado um trabalho, em função de p e de V, dado por e sua temperatura absoluta terá sofrido um aumento de .
A alternativa que preenche, correta e respectivamente, as lacunas acima é
- A) 3pV/2, 50%.
- B) 3pV/2, 25%.
- C) 3pV/2, 15%.
- D) 2pV/3, 50%.
- E) 2pV/3, 25%.
A alternativa correta é letra A) 3pV/2, 50%.
Pessoal, para calcularmos o trabalho precisamos calcular a área abaixo da transformação.
W = (3V - V) times 0,5 p + dfrac{(3V-V) times 0,5p}{2}
W = 1,5 p V = dfrac{3pV}{2}
Para verificarmos a temperatura,
(dfrac{PV}{T})_{antes} = (dfrac{PV}{T})_{depois}
dfrac{pV}{T_{antes}} = dfrac{0,5p times 3 V}{T_{depois}}
T_{depois} = 1,5 T_{antes}
Isso corresponde a um aumento de 50%.
Gabarito: LETRA A.
353) Um recipiente de gás tem uma parede que pode suportar pressão máxima de 2,2 MPa. O recipiente contém gás a 4,0 × 105 Pa e 350 K. Se o recipiente estiver sendo aquecido constantemente, negligenciando a mudança de volume, a temperatura na qual a parede do recipiente se rompe é, em graus Celsius:
- A) 162,5.
- B) 192,5.
- C) 826.
- D) 1.652.
- E) 1.925.
A alternativa correta é letra D) 1.652.
Gabarito: LETRA D.
Para determinar a temperatura na qual a parede do recipiente se rompe, podemos utilizar a Lei dos Gases Ideais, que é dada por:
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Onde P, V e T são as pressões, os volumes e as temperaturas dos estados 1 e 2 de um gás ideal, respectivamente.
Se a mudança de volume é negligenciada, isto é, sem alteração de volume, temos que V_2 = V_1. Assim, a equação se torna:
dfrac { P_1 cdot cancel{V_1} } { T_1 } = dfrac { P_2 cdot cancel{V_1} } { T_2 }
dfrac { P_1 } { T_1 } = dfrac { P_2 } { T_2 }
dfrac { T_1 }{ P_1 } = dfrac { T_2 }{ P_2 }
T_2 = dfrac { P_2 }{ P_1 } cdot T_1
No estado 1, o gás apresenta uma pressão P_1 = 4,0 times 10^5 , Pa e uma temperatura T_1 = 350 , K. No estado 2, o gás apresenta a pressão máxima P = 2,2 , MPa = 2,2 times 10^6 , Pa. Substituindo esse valores na equação acima, temos:
T_2 = dfrac { 2,2 times 10^6 }{ 4,0 times 10^5 } cdot 350
T_2 = 1925 , K
Para converter a temperatura de Kelvin para graus Celsius, subtraímos 273,15:
T_C = T_K - 273,15
Logo,
T_C = 1925 - 273,15
T_C =1651, 85 , °C
Portanto, a resposta correta é a alternativa (d).
354)
- A) 250 K, 250 K e 1000 K.
- B) 250 K, 500 K e 1000 K.
- C) 500 K, 1000 K e 1000 K.
- D) 500 K, 500 K e 1000 K.
A resposta correta é a letra C) 500 K, 1000 K e 1000 K.
Para entender por quê, vamos analisar as transformações do motor. A transformação AB é uma expansão isoterma, pois a temperatura é constante em 250 K. Já a transformação BC é uma compressão isobárica, pois a pressão é constante. Por fim, a transformação CA é uma expansão isobárica, pois a pressão é constante.
Podemos calcular a variação de entropia (ΔS) em cada transformação utilizando a fórmula:
$$ΔS = nR ln frac{T_2}{T_1}$$onde n é o número de moles de gás (0,4 mol), R é a constante dos gases (8,3 J/mol·K) e T1 e T2 são as temperaturas inicial e final, respectivamente.
Para a transformação AB, T1 = T2 = 250 K, então ΔS = 0, pois a temperatura é constante.
Para a transformação BC, T1 = 250 K e T2 = 500 K, então:
$$ΔS = 0,4 times 8,3 times ln frac{500}{250} = 2,49 frac{J}{K}$$Para a transformação CA, T1 = 500 K e T2 = 1000 K, então:
$$ΔS = 0,4 times 8,3 times ln frac{1000}{500} = 4,98 frac{J}{K}$$Portanto, as temperaturas nos pontos A, B e C são, respectivamente, 500 K, 1000 K e 1000 K, que correspondem à alternativa C).
355) Considere as afirmações abaixo sobre gases ideais.
- A) Apenas I.
- B) Apenas II.
- C) Apenas III.
- D) Apenas I e II.
- E) I, II e III.
Resposta: A alternativa correta é letra E) I, II e III.
Explicação:
Vamos analisar cada uma das afirmações sobre gases ideais:
I - Um mol de qualquer gás ideal, nas condições normais de temperatura e pressão, ocupa sempre o mesmo volume no espaço.
Essa afirmação é verdadeira. Em condições normais de temperatura e pressão, todos os gases ideais ocupam o mesmo volume, que é de 22,4 litros por mol.
II - Em um processo isobárico reversível, a variação de entalpia é igual ao calor transferido.
Essa afirmação também é verdadeira. Em um processo isobárico reversível, a variação de entalpia (ΔH) é igual ao calor transferido (Q) entre o sistema e o ambiente. Isso é descrito pela equação ΔH = Q.
III - A energia interna de um gás ideal depende apenas de uma variável de estado termodinâmico.
Essa afirmação é verdadeira. A energia interna de um gás ideal depende apenas da temperatura. Isso é descrito pela equação U = (3/2)nRT, onde U é a energia interna, n é o número de moles, R é a constante dos gases ideais e T é a temperatura em kelvin.
Portanto, todas as três afirmações são verdadeiras, e a alternativa correta é letra E) I, II e III.
356) Em uma atividade experimental hipotética, um jovem cientista tem à sua disposição 200 ml de um certo gás, inicialmente a 27ºC e com pressão de 4 atm. Ao realizar uma transformação isobárica, o gás passou a ocupar um volume de 400 ml. Admitindo-se que o gás é ideal, qual será a nova temperatura desse gás?
- A) 600ºC.
- B) 54ºC.
- C) 327ºC.
- D) 108ºC.
- E) 222ºC.
A alternativa correta é letra C) 327ºC.
Gabarito: LETRA C.
Utilizando a equação dos gases ideais, podemos escrever
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Como a transformação é isobárica, temos que P_1 = P_2. Assim, a equação acima se torna:
dfrac { cancel { P_1 } cdot V_1 } { T_1 } = dfrac { cancel { P_1 } cdot V_2 } { T_2 }
T_2 = dfrac { T_1 cdot V_2 } { V_1 }
Lembrando que devemos utilizar as temperaturas na escala Kelvin (T_1 = 27°C = 27 + 273 = 300 , K), temos que
T_2 = dfrac { T_1 cdot V_2 } { V_1 }
T_2 = dfrac { 300 cdot 0,4 } { 0,2 }
T_2 = 600 , K
Convertendo para a escala Celsius, temos
T_2 = 600 - 273
T_2 = 327 , °C
Portanto, a resposta correta é a alternativa (c).
357) A expansão rápida de um gás caracteriza uma transformação adiabática quando ocorre o resfriamento do gás sem que haja tempo para perdas de calor. Sua aplicação em refrigeradores é bastante conhecida, bem como efeitos cotidianos como no ar que sai das latas de spray é mais frio, quando assopramos as mãos, e em inúmeros processos ligados aos fenômenos atmosféricos.
- A) V2 / V1 = 22,5
- B) V2 / V1 = 2
- C) V2 / V1 = 21.4
- D) V2 / V1 = 20.7
- E) V2 / V1 = 22
A alternativa correta é letra A) V2 / V1 = 22,5
Gabarito: LETRA A.
De acordo com a lei geral dos gases ideais, podemos escrever:
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Como T_2 = dfrac { T_1 } 2, temos
dfrac { P_1 cdot V_1 } { cancel { T_1 } } = dfrac { P_2 cdot V_2 } { dfrac { cancel { T_1 } } 2 }
P_1 cdot V_1 = 2 P_2 cdot V_2
dfrac { V_2 } { V_1 } = dfrac 12 dfrac { P_1 } { P_2 } tag 1
Como o enunciado menciona, para transformações adiabáticas, podemos escrever:
P_1 cdot {V_1}^gamma = P_2 cdot {V_2}^gamma
Logo,
dfrac { P_1 } { P_2 } = dfrac { {V_2}^gamma } { {V_1}^gamma }
dfrac { P_1 } { P_2 } = left( dfrac { V_2 } { V_1 } right)^gamma tag 2
Substituindo (2) em (1), temos:
dfrac { V_2 } { V_1 } = dfrac 12left( dfrac { V_2 } { V_1 } right)^gamma
left( dfrac { V_2 } { V_1 } right)^gamma = 2 dfrac { V_2 } { V_1 }
dfrac { left( dfrac { V_2 } { V_1 } right)^gamma } { dfrac { V_2 } { V_1 } } = 2
left( dfrac { V_2 } { V_1 } right)^{gamma -1 } = 2
Substituindo gamma = 1,4, temos:
left( dfrac { V_2 } { V_1 } right)^{1,4 -1 } = 2
left( dfrac { V_2 } { V_1 } right)^{0,4} = 2
left( dfrac { V_2 } { V_1 } right)^{frac25} = 2
left[ left( dfrac { V_2 } { V_1 } right)^{frac25} right]^{frac 52} = 2^{frac 52}
dfrac { V_2 } { V_1 } = 2^{2,5}
Portanto, a resposta correta é a alternativa (a).
358) Julgue o item que se segue, relacionados às propriedades dos fluidos.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Correta a afirmativa pois tanto pressão quanto a temperatura de um gás irá influir na sua densidade, pois isso irá determinar o quanto as moléculas do gás estarão mais próximas ou mais afastadas umas das outras.
Gabarito: Certo
359) Acerca do conceito de vazão volumétrica em gases, julgue o item que se segue.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
A vazão de líquidos e gases é frequentemente expressa em termos de vazão volumétrica. A vazão volumétrica, , é definida como:
q_v=frac{q_m}{rho}
Em que:
q_m= vazão em massa, kg/s;
rho= densidade de referência do fluido, kg/m³.
A vazão volumétrica deve, portanto, ser entendida como sendo o volume de um fluido que passa por um elemento primário por unidade de tempo, estando o fluido (ou gás) na pressão e temperatura de referência. No Brasil, as condições de referência normalmente utilizadas para gases são 0ºC e 101325 Pa.
Entretanto, as condições de referência utilizadas podem variar de local para local, de forma que, quando a vazão é dada em termos volumétricos, é uma boa prática explicar quais são as condições de referência.
Gabarito: Certo
360) Assinale a alternativa INCORRETA sobre matéria e energia.
- A) A ligação covalente se dá entre átomos que apresentam alta eletronegatividade, não metais e entre hidrogênio e não metais.
- B) Na medicina, os radiofármacos são utilizados com propósito de diagnóstico ou tratamento terapêutico. Entre os radiofármacos, pode-se citar: Tecnécio 99, Iodo 131 e Flúor 18.
- C) Uma substância no estado gasoso se mantém como gás enquanto a temperatura for igual ou menor do que a temperatura crítica e, caso a temperatura seja maior do que a temperatura crítica, ela se torna um vapor.
- D) É um exemplo de sublimação: gelo seco + água = gás carbônico.
- E) A ligação iônica resulta da atração eletrostática entre cargas opostas: os metais, que apresentam alta eletropositividade, e os não metais, que apresentam alta eletronegatividade.
A alternativa correta é letra C) Uma substância no estado gasoso se mantém como gás enquanto a temperatura for igual ou menor do que a temperatura crítica e, caso a temperatura seja maior do que a temperatura crítica, ela se torna um vapor.
Analisemos as alternativas:
a) A ligação covalente se dá entre átomos que apresentam alta eletronegatividade, não metais e entre hidrogênio e não metais. Verdadeiro. Ligação covalente é a interação interatômica entre átomos de natureza não metálica por meio do compartilhamento de elétrons. Ligação covalente é um tipo de interação entre átomos que apresentam alta eletronegatividade, ou seja, elevada tendência de receber elétrons.
b) Na medicina, os radiofármacos são utilizados com propósito de diagnóstico ou tratamento terapêutico. Entre os radiofármacos, pode-se citar: Tecnécio 99, Iodo 131 e Flúor 18. Verdadeiro. Os radiofármacos são medicamentos administrados, em sua maioria, por via intravenosa e utilizados em Medicina Nuclear para fins de diagnóstico e/ou terapia de doenças.
Os radionuclídeos emissores de raios gama comumente utilizados para este fim são: Tecnécio-99m (99mTc - T½ de 6,0 h); Iodo-123 (123I - T½ de 13,0 h); Índio-111 ( 111In - T½ de 67,3 h); Tálio-201 (201TI - T½ de 73,0 h) e Gálio-67 (67Ga - T½ de 78,3 h).
Outro tipo de emissão beta é o pósitron (β+), que consiste na transformação de um próton em nêutron e pósitron (antielétron), uma vez que o núcleo se encontra instável devido ao número elevado de prótons. Após sua emissão do núcleo, os pósitrons são quase que instantaneamente aniquilados dando origem a dois fótons com mesma energia (511 keV) e direções opostas. Esse tipo de radiação é utilizado na medicina diagnóstica. Exemplo de radionuclídeos emissores de pósitrons: gálio-68 (68Ga), flúor-18 (18F).
Fonte: https://www.crfsp.org.br/images/cartilhas/radiofarmacia.pdf
c) Uma substância no estado gasoso se mantém como gás enquanto a temperatura for igual ou menor do que a temperatura crítica e, caso a temperatura seja maior do que a temperatura crítica, ela se torna um vapor. Falso. A temperatura crítica é a temperatura acima da qual um gás não pode ser liquefeito por um aumento de pressão, isto é, o valor de temperatura acima do qual é impossível que um gás condense, por maior que seja a pressão a que este se encontre submetido.
d) É um exemplo de sublimação: gelo seco + água = gás carbônico. Verdadeiro. Sublimação é a mudança de estado físico do estado sólido diretamente para o estado gasoso, o que pode não ser muito intuitivo à primeira vista, uma vez que estamos acostumados a visualizar líquidos se transformar em vapor. Entretanto, o fenômeno da sublimação pode ocorrer em temperatura ambiente.
e) A ligação iônica resulta da atração eletrostática entre cargas opostas: os metais, que apresentam alta eletropositividade, e os não metais, que apresentam alta eletronegatividade. Verdadeiro.
Gabarito: C
