Questões Sobre Termologia - Física - concurso
361) Suponha que n mols de gás ideal vai de um estado inicial (V_1, T_1) para um estado final (V_1+Delta V, T_1+ Delta T) sob pressão P constante, onde as variáveis V e T representam, respectivamente, volume e temperatura absoluta. Vamos definir o coeficiente de dilatação “efetivo” do gás neste processo como sendo γ=Delta V/(V_1. Delta T). Com base nestas informações e sendo R a constante dos gases, podemos dizer que:
- A) γ={large{1 over T_1}}.
- B) γ={large{1 over T_2}}.
- C) γ={large{2 over T_2}}.
- D) γ={large{3 over T_1}}.
- E) γ={large{n over T_1}}.
A alternativa correta é letra A) γ={large{1 over T_1}}.
Gabarito: LETRA A.
De acordo com a lei dos gases ideais, podemos escrever:
PV = nRT
Onde P é a pressão, V é o volume, n é o número de mols, R é a constante dos gases ideais e T é a temperatura absoluta. Assim, para o estado inicial, temos:
PV_1 = nRT_1
Agora, vamos considerar o estado final, onde o volume é left( V_1 + Delta V right) e a temperatura é left( T_1 + Delta T right). Substituindo na equação dos gases ideais, lembrando que a pressão é constante, temos:
P left( V_1 + Delta V right) = nR left( T_1 + Delta T right)
Logo,
PV_1 + PDelta V = nRT_1 + nRDelta T
Porém, encontramos que PV_1 = nRT_1. Logo,
cancel {nRT_1} + PDelta V = cancel {nRT_1} + nRDelta T
PDelta V = nRDelta T
dfrac { Delta V } { Delta T } = dfrac { nR }{ P }
Entretanto, da relação PV_1 = nRT_1, temos que dfrac {nR}{P} = dfrac {V_1}{T_1}. Logo,
dfrac { Delta V } { Delta T } = dfrac {V_1}{T_1}
dfrac { Delta V } { V_1Delta T } = dfrac {1}{T_1}
Como γ=dfrac { Delta V } { V_1Delta T } , temos:
γ=dfrac 1{T_1}
Portanto, a resposta correta é a alternativa (a).
362) Suponha que n mols de gás ideal evolui por um processo isotérmico reversível. Se seu volume diminuir então:
- A) Sua energia interna e sua pressão aumentam.
- B) Sua energia interna permanece constante e sua temperatura aumenta.
- C) Sua energia interna e sua pressão diminuem.
- D) Sua pressão, sua temperatura e sua energia interna aumentam.
- E) Sua energia interna permanece constante e sua pressão aumenta.
A alternativa correta é letra E) Sua energia interna permanece constante e sua pressão aumenta.
Gabarito: LETRA E.
De acordo com a teoria cinética dos gases, energia interna de um sistema está diretamente relacionada à sua temperatura. Dessa forma, em um processo isotérmico reversível, no qual a temperatura permanece constante, a energia interna também permanece constante.
Agora, para determinar o que acontece com a pressão e o volume, podemos utilizar a equação dos gases ideais:
PV = nRT
Mantendo o número de mols e a temperatura constantes, temos que:
PV = text{constante}
Isso significa que a pressão e o volume são inversamente proporcionais. Logo, se o volume diminuir, a pressão aumenta.
Portanto, a resposta correta é a alternativa (e).
363) Suponha que 3 mols de um gás ideal, colocado num recipiente de volume V, possua temperatura T. Suponha também que, devido a um vazamento, 1mol saiu do recipiente após um certo tempo. Caso a pressão do gás não se altere neste processo então o gás teve sua temperatura aumentada para:
- A) 4T
- B) 3T
- C) 1,5T
- D) 5T
- E) 2,5T
A alternativa correta é letra C) 1,5T
Gabarito: LETRA C.
Para resolver essa questão, podemos usar a Lei dos Gases Ideais, que relaciona a pressão (P), o volume (V), o número de mols (n) e a temperatura (T) de um gás ideal:
PV = nRT
Temos inicialmente 3 mols do gás no recipiente com pressão P, temperatura T e volume V. Assim, podemos escrever:
PV = 3RT tag 1
Como 1 mol do gás vazou, teremos 2 mols do gás restantes no recipiente. Entretanto, a pressão e o volume do recipiente não se alteraram. Então, sendo T_2 a temperatura após o processo, temos que:
PV = 2RT_2 tag 2
Como queremos encontrar a nova temperatura T_2, podemos igualar as equações (1) e (2):
2cancel R T_2 = 3 cancel R T
T_2 = dfrac 32 T
T_2 = 1,5T
Portanto, a resposta correta é a alternativa (c).
364) Um balão tem um volume V = 1,6 × 103 m3 de ar quente no seu interior na temperatura T = 400 K e na pressão atmosférica p0 = 1,0 atm = 1,0 × 105 Pa. Sabendo-se que o ar quente se comporta como um gás ideal e que a constante universal dos gases é R ≅ 8 J/mol.K, quantos mols de ar n há no interior do balão?
- A) 5,0 × 10−1 mol.
- B) 4,0 × 100 mol.
- C) 5,0 × 104 mol.
- D) 4,0 × 105 mol.
A alternativa correta é letra C) 5,0 × 104 mol.
Gabarito: LETRA C.
Para calcular a quantidade de mols no interior do balão, podemos utilizar a equação dos gases ideais:
PV = nRT
Onde:
- P é a pressão,
- V é o volume,
- n é a quantidade de mols,
- R é a constante universal dos gases ideais e
- T é a temperatura.
Podemos rearranjar a equação para encontrar n:
n = dfrac{PV}{RT}
Substituindo os valores do enunciado, temos:
n = dfrac{ 1,0 times 10^5 cdot 1,6 times 10^3 }{ 8 cdot 400 }
n = 5,0 times 10^4 , mol
Portanto, a resposta correta é a alternativa (c).
365) A equação de Clapeyron para um gás ideal estabelece a relação da temperatura absoluta (T), da pressão (ρ) e do volume (V) desse gás com o número de moles (n) e a constante universal dos gases ideais (R). Admita que, após uma determinada transformação de um gás ideal de massa constante, sua pressão e seu volume duplicaram. Nesse caso, a temperatura do gás, em grau Kelvin,
- A) caiu pela metade.
- B) foi mantida.
- C) duplicou.
- D) triplicou.
- E) quadruplicou
A alternativa correta é letra E) quadruplicou
Gabarito: LETRA E.
A equação de Clapeyron para um gás ideal mencionada no enunciado é dada por:
PV = nRT
Onde P é a pressão, V é o volume, n é o número de mols, R é a constante universal dos gases ideais e T é a temperatura. Assim, para uma determinada quantidade de um gás ideal, podemos escrever:
dfrac {PV}T = nR = text{constante}
Isso significa que a relação entre pressão, volume e temperatura entre dois estados de um gás ideal é dada por:
dfrac { P_1 cdot V_1 } { T_1 } = dfrac { P_2 cdot V_2 } { T_2 }
Se a pressão e o volume duplicaram, temos que P_2 = 2 P_1 e V_2 = 2 V_1. Então,
dfrac { cancel{ P_1 } cdot cancel{ V_1 } } { T_1 } = dfrac { 2 cancel{ P_1 } cdot 2 cancel{ V_1 } } { T_2 }
dfrac 1 { T_1 } = dfrac 4 { T_2 }
T_2 = 4 T_1
Nesse caso, a temperatura do gás, em grau Kelvin, quadruplicou.
Portanto, a resposta correta é a alternativa (e).
Questão 366
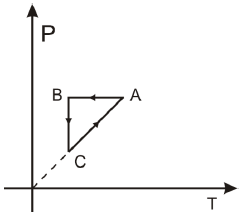
O gráfico pressão versus volume equivalente as transformações ABCA é:
- A)
- B)
- C)
- D)
A resposta certa é a letra D). O gráfico de pressão versus volume é caracterizado por uma isoterma (processo A), uma adiabata (processo BC) e outra isoterma (processo CA). Isso ocorre porque o gás ideal monoatômico sofre expansão isoterma (A), compressão adiabática (B) e compressão isoterma (C).
Na transformação A, a temperatura é constante, portanto, a isoterma é uma linha horizontal no gráfico de pressão versus volume. Já na transformação BC, a entalpia do gás aumenta, pois a temperatura aumenta durante a compressão adiabática, portanto, a adiabata é uma linha inclinada no gráfico de pressão versus volume. Finalmente, na transformação CA, a temperatura é novamente constante, portanto, a isoterma é outra linha horizontal no gráfico de pressão versus volume.
O gráfico de pressão versus temperatura é caracterizado por uma linha reta que passa pela origem, pois a pressão é diretamente proporcional à temperatura em um gás ideal monoatômico. Portanto, apenas a opção D) apresenta o gráfico correto de pressão versus temperatura para o processo cíclico ABCA.
É importante notar que o gráfico de pressão versus volume também pode ser utilizado para analisar o processo cíclico ABCA. Nesse caso, o gráfico apresentaria uma isoterma (A), uma adiabata (B) e outra isoterma (C). No entanto, como a questão pede o gráfico de pressão versus temperatura, a resposta certa é a opção D).
Questão 367
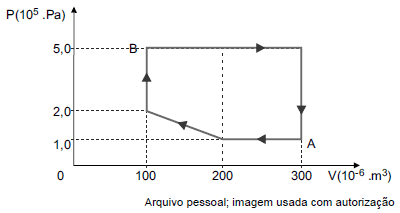
Ao fim de um ciclo, o trabalho realizado pela amostra é de joules e a sua temperatura no estado B é de ºC.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas.
- A) 75 ... 227.
- B) 75 ... 177.
- C) 125 ... 127.
- D) 135 ... 113.
- E) 125 ... 117.
A alternativa correta é letra A) 75 ... 227.
Pessoal, o trabalho equivale a área toda do ciclo.
Logo,
A = dfrac{ (2 - 1) times (200 - 100)}{2} + (5 - 2) times (200 - 100) + (5 - 1) times (300 - 200)
Reparem que calculei primeiro a área do triângulo, depois dos dois retângulos (da esquerda para a direita).
A = 750
O trabalho, por sua vez, precisa ser aplicado multiplicando as potencias decimais. Não fiz isso no cálculo da área para não ficar confuso.
W = 750 times 10^5 times 10^{-6}
W = 75 , J
Agora, para o cálculo de temperatura.
(dfrac{PV}{T})_A = (dfrac{PV}{T})_B
dfrac{300 times 10^{-6} times 1,0 times 10^5}{300} = dfrac{100 times 10^{-6} times 5 times 10^5}{T_B}
T_B = 500 , K
T_B = 227 , ºC
Gabarito: LETRA A.
368) O texto a seguir é referência para a questão.
- A) V = V0
- B) V = frac {V_0} {4}
- C) V = 4V0
- D) V = 2V0
- E) V = frac {V_0} {2}
A alternativa correta é letra E) V = frac {V_0} {2}
Pessoal, precisamos conhecer a relação
dfrac{P_0V_0}{T_0} = dfrac{PV}{T}
Logo, substituindo pelas informações que o enunciado nos deu,
dfrac{P_0V_0}{T_0} = dfrac{4 P_0 V}{2T_0}
V_0 = 2 V
Como ele quer V em função de V0, devemos deixar V isolado.
V = dfrac{V_0}{2}
Gabarito: LETRA E.
369) No Museu Interativo da Física – UFRJ (LADIF), um experimento consiste em colocar um copo de água em uma mesa de vácuo fechada por uma redoma. Ao ligar uma bomba acoplada à mesa de vácuo, o ar é retirado da redoma e a água ferve. Esse fenômeno ocorre, porque, dentro da redoma, ao ligar a bomba:
- A) a pressão diminui e a temperatura aumenta, atingindo a temperatura de ebulição da água.
- B) o ponto de ebulição da água diminui, porque a pressão aumenta; e a água ferve apesar de a temperatura manter-se constante.
- C) a pressão mantém-se constante e a temperatura aumenta, atingindo a temperatura de ebulição da água.
- D) a pressão aumenta e a temperatura aumenta, atingindo a temperatura de ebulição da água.
- E) o ponto de ebulição da água diminui, porque a pressão diminui; e a água ferve apesar de a temperatura manter-se constante.
A alternativa correta é letra E) o ponto de ebulição da água diminui, porque a pressão diminui; e a água ferve apesar de a temperatura manter-se constante.
Pessoal, ao retirarmos o ar, temos que a pressão diminui.
P V = n R T
Reparem que o número de mols do ar n está diminuindo. Logo, a pressão também diminui.
OBS: o volume permanece igual pessoal. Reparem que não estamos diminuindo o volume do recipiente, apenas removendo matéria dele.
Com a pressão menor, a temperatura de ebulição da substância também será menor.
Isso porque o ar está exercendo menos força (pressão) nas moléculas do líquido. Logo, elas conseguem "se desprender" virando gás mais facilmente.
Situação inversa ocorre na panela de pressão, pessoal. Como a pressão é maior, a temperatura de ebulição da água é maior. Isso faz com que ela passe de 100 graus Celcius ainda na fase líquida, melhorando a eficiência de cozimento.
Gabarito: LETRA E.
Questão 370

Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
A DMV implica na possibilidade de violação de um ou mais princípios da Teoria da Relatividade Especial.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Pessoal, realmente.
A DMV é aplicada a velocidade de gases que, normalmente, não excedem a velocidade da luz.
A Teoria da Relatividade Espacial se aplica a velocidades inferiores a da luz.
Entretanto, a DMV pode ser aplicada a gases extremamente aquecidos, situação essa que violaria os princípios da TRE.
Logo, pelo termo "possibilidade" no enunciado, a questão está correta.
Gabarito: CERTO.




