Questões Sobre Termologia - Física - concurso
Questão 371
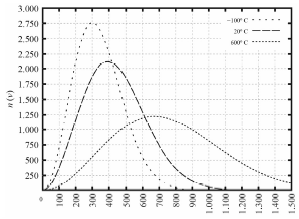
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L atm K-1 mol-1, julgue o item a seguir.
Um corpo de massa 1 kg com energia cinética constante igual a 3 J irá produzir uma temperatura superior a 6 ºC.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, vamos calcular a velocidade de tal corpo.
É estranho usar a fórmula de energia cinética para calcular gases. Porém, como o corpo tem 1 kg, podemos utiliza-la
E_C = dfrac{mv^2}{2}
3 = dfrac{1.000 v^2}[2}
v = sqrt {dfrac{6}{1.000}}
Reparem que esse valor é minúsculo, o que para uma questão como essa não se aplica.
Gabarito: ANULADA.
Questão 372
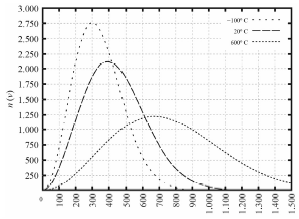
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
Para T , = , -100 , ºC, a velocidade quadrática média das moléculas será igual a 300 sqrt {3} , m/s.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, segundo o enunciado, temos que
v_{QM} = sqrt {dfrac{3 k T}{m}}
v_{QM} = sqrt {dfrac{3 k T}{n times MM}}
Na velocidade dada, temos que a velocidade seria 520 m/s aproximadamente, isso forneceria um número n de aproximadamente 1.250
v_{QM} = sqrt {dfrac{3 times 1,38 times 10^{-23} times 127,15}{1.250 times 32}}
Reparem que a constante de Boltzmann coloca o valor em uma escala muito pequena, que não condiz com a velocidade de um gás.
Gabarito: ANULADA.
Questão 373
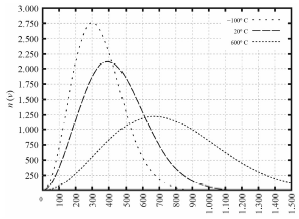
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
As três curvas apresentadas no gráfico têm a mesma área.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
Pessoal, o que temos nessa questão é um gráfico de distribuição de probabilidades.
A área sob a curva da distribuição de Maxwell-Boltzmann representa a probabilidade total e é sempre igual a 1 (ou 100% se considerada em termos percentuais). Isso significa que, independentemente da temperatura, a integral (soma da área) da função de distribuição sobre todas as velocidades é a mesma.
Logo,
Gabarito: CERTO.
Questão 374
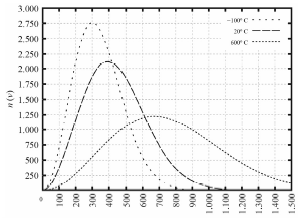
Tendo como referência as informações precedentes e considerando que o zero absoluto é -273,15 K e que a constante dos gases é R 0,082 L ⋅ atm ⋅ K-1 ⋅ mol-1, julgue o item a seguir.
Se os recipientes contêm 4 g de moléculas de oxigênio acondicionadas em 2 L, então, para T = -100 ºC, a pressão será inferior a 1 atm.
- A) Certo
- B) Errado
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Pessoal, precisamos aplicar
P V = n R T
P V = dfrac{m}{MM} times R times T
P times 4 = dfrac{4}{32} times 0,082 times (273 - 100)
P = 0,39 , atm
Gabarito: ANULADA.
A questão, entretanto, foi ANULADA.
375) Em um cilindro, há um volume de 98,4 litros de CO2 sob uma pressão de 2 atm.
- A) 5,5 g
- B) 44 g
- C) 352 g
- D) 3911 g
- E) 5000 g
A alternativa correta é letra C) 352 g
Pessoal, aqui precisamos aplicar a clássica relação
P V = n R T
P V = dfrac{m}{MM} R T
Agora, reparem que temos tudo nas unidades necessárias, menos a temperatura que precisa estar em Kelvin.
2 times 98,4 = dfrac{m}{44} times 0,082 times 300
196,8 = dfrac{m}{44} times 24,2
m = 352 , g
Gabarito: LETRA C.
376) A pressão manométrica de um pneu de automóvel é de 205 kPa antes de iniciar uma viagem em um local onde a pressão atmosférica é de 95 kPa e a temperatura é de 25ºC (considere que o ar no interior do pneu está em equilíbrio térmico com o meio externo). Ao término da viagem, a pressão manométrica verificada no mesmo pneu foi de 225 kPa, em uma cidade onde a pressão atmosférica é de 105 kPa. Admitindo que o comportamento do ar seja igual ao comportamento de um gás ideal e sabendo que o volume do pneu aumentou em 5%, assinale a opção que apresenta a melhor aproximação para a temperatura do ar do pneu medida após o término da viagem.
- A) 29ºC
- B) 35ºC
- C) 44ºC
- D) 71ºC
- E) 85ºC
Resposta: D) 71°C
Para encontrar a temperatura do ar no pneu após o término da viagem, precisamos aplicar a lei dos gases ideais, que relaciona a pressão, volume e temperatura dos gases.
A lei dos gases ideais é dada pela fórmula:
$$PV = nRT$$
Onde:
- $P$ é a pressão do gás;
- $V$ é o volume do gás;
- $n$ é a quantidade de substância do gás (número de moles);
- $R$ é a constante dos gases ideais;
- $T$ é a temperatura do gás em Kelvin.
No nosso caso, sabemos que:
- A pressão inicial do ar no pneu é de 205 kPa;
- A pressão atmosférica é de 95 kPa;
- A temperatura inicial é de 25°C = 298 K;
- O volume do pneu aumentou em 5%;
- A pressão final do ar no pneu é de 225 kPa.
Como o volume do pneu aumentou em 5%, podemos calcular o novo volume como:
$$V_f = V_i times 1,05$$
Onde $V_i$ é o volume inicial do pneu e $V_f$ é o volume final do pneu.
Agora, podemos aplicar a lei dos gases ideais para encontrar a temperatura final do ar no pneu.
$$P_fV_f = nRT_f$$
Onde $P_f$ é a pressão final do ar no pneu, $V_f$ é o volume final do pneu e $T_f$ é a temperatura final do ar no pneu que queremos encontrar.
Como sabemos que a quantidade de substância do gás não mudou, podemos igualar a equação acima com a equação inicial:
$$P_iV_i = nRT_i$$
Onde $P_i$ é a pressão inicial do ar no pneu, $V_i$ é o volume inicial do pneu e $T_i$ é a temperatura inicial do ar no pneu.
Agora, podemos dividir as duas equações para eliminar a constante dos gases ideais e a quantidade de substância do gás:
$$frac{P_fV_f}{P_iV_i} = frac{T_f}{T_i}$$
Substituindo os valores conhecidos, obtemos:
$$frac{225 times 1,05V_i}{205V_i} = frac{T_f}{298}$$
$$Rightarrow T_f = frac{225 times 1,05}{205} times 298$$
$$Rightarrow T_f approx 71°C$$
Portanto, a temperatura do ar no pneu após o término da viagem é de aproximadamente 71°C.
377) Caso se acenda uma lareira com a chaminé fechada em uma sala completamente fechada, é correto afirmar que
- A) Apenas o item II está certo.
- B) Apenas o item III está certo.
- C) Apenas os itens I e II estão certos.
- D) Apenas os itens I e III estão certos.
- E) Todos os itens estão certos.
A alternativa correta é letra C) Apenas os itens I e II estão certos.
Gabarito: LETRA C.
Vamos analisar cada uma das afirmativas:
I a pressão dentro da sala irá crescer.
Correto. Quando uma lareira é acesa em uma sala completamente fechada, com a chaminé também fechada, a queima da madeira produz calor, o que aumenta a temperatura do ar na sala.
De acordo com a lei dos gases ideais (PV = nRT), onde P é a pressão, V é o volume, n é a quantidade de gás, R é a constante dos gases, e T é a temperatura, podemos observar que, aumentando a temperatura, a pressão do ar dentro da sala também aumenta.
II a temperatura dentro da sala irá aumentar.
Correto. Como mencionado, o calor gerado pela queima da madeira da lareira aumentará a temperatura do ar dentro da sala.
III a energia cinética média das partículas no ar não irá se alterar.
Incorreto. A temperatura é uma medida da energia cinética média das partículas. Se a temperatura dentro da sala aumenta, como indicado nas afirmações anteriores, então a energia cinética média das partículas no ar também aumenta.
Portanto, a resposta correta é a alternativa (c).
378) Um gás ideal monoatômico, inicialmente ocupando um volume de 1,0 litro a uma pressão de 105 Pa, expande isobaricamente, quadruplicando seu volume. Depois, esse gás sofre uma contração isotérmica até seu volume original.
- A) 920 J.
- B) 340 J.
- C) 730 J.
- D) 570 J.
- E) 460 J.
Como a questão foi anulada, não há uma resposta correta entre as opções apresentadas. No entanto, vamos analisar a situação física descrita e entender como podemos calcular a soma total de calor perdido e recebido pelo gás e o trabalho total realizado pelo gás.
Na expansão isobárica, o gás realiza trabalho sobre o meio externo, pois o volume aumenta. O trabalho realizado pelo gás é dado por $W = P Delta V$, onde $P$ é a pressão constante e $Delta V$ é a variação de volume. Nesse caso, o volume inicial é de 1,0 litro e o volume final é de 4,0 litros, pois o volume quadruplicou. Portanto, $Delta V = 3,0$ litros.
O trabalho realizado pelo gás durante a expansão isobárica é $W = 105 Pa cdot 3,0 L = 315 J$. Agora, durante a contração isoterma, o gás não realiza trabalho, pois o volume diminui a pressão constante.
Para calcular a soma total de calor perdido e recebido pelo gás, precisamos considerar a equação de estado do gás ideal, $PV = nRT$. Como o gás é monoatômico, $nR = frac{P_1 V_1}{T_1} = frac{P_2 V_2}{T_2}$, onde $P_1, V_1, T_1$ são a pressão, volume e temperatura inicial, e $P_2, V_2, T_2$ são a pressão, volume e temperatura final. Como a temperatura é constante durante a contração isoterma, $T_1 = T_2$.
Portanto, $P_1 V_1 = P_2 V_2$, e como $P_1 = 105 Pa$ e $V_1 = 1,0 L$, temos $P_2 = frac{P_1 V_1}{V_2} = frac{105 Pa cdot 1,0 L}{1,0 L} = 105 Pa$.
Como o gás não realiza trabalho durante a contração isoterma, a variação de energia interna é zero, e portanto, o calor recebido pelo gás é igual ao trabalho realizado durante a expansão isobárica, $Q = W = 315 J$.
Portanto, a soma total de calor perdido e recebido pelo gás é $Q - W = 315 J - 315 J = 0 J$. Isso é esperado, pois o processo como um todo é isotérmico, e portanto, a variação de energia interna é zero.
379) Com relação às propriedades dos fluidos, julgue o item a seguir.
- A) Certo
- B) Errado
A alternativa correta é a letra B) Errado
A densidade de um gás não é independente das condições de pressão e temperatura. Isso ocorre porque a densidade de um gás é diretamente proporcional à pressão e inversamente proporcional à temperatura. Portanto, se a pressão ou a temperatura de um gás mudar, sua densidade também mudará.
Por exemplo, se aumentarmos a pressão de um gás, suas moléculas se aproximam mais umas das outras, aumentando a densidade do gás. Da mesma forma, se diminuirmos a temperatura de um gás, suas moléculas se moverão mais lentamente, ocupando menos espaço e aumentando a densidade do gás.
Logo, é errado afirmar que a densidade de um gás é independente das condições de pressão e temperatura.
380) Suponha-se que uma típica câmara de ultra-alto-vácuo seja mantida a pressão e temperatura constantes, iguais a 1,38 times 10−8 Pa e 100 K, respectivamente. Nessa situação, considerando-se que k=frac{PV}{NT}=1,38 times 10^{-23}J/K, em que corresponde à pressão, V, ao volume, T, à temperatura e N, à quantidade de moléculas, é correto concluir que a quantidade de moléculas por metro cúbico existentes dentro da câmara é igual a
- A) 4,00 × 106.
- B) 1,00 × 10−13.
- C) 1,00 × 1013.
- D) 1,24 × 10−10.
- E) 1,38 × 10−6.
A alternativa correta é letra C) 1,00 × 1013.
Pessoal, para achar a relação moléculas por volume, precisamos rearranjar a expressão acima.
dfrac{N}{V} = dfrac{P}{kT}
dfrac{N}{V} = dfrac{ 1,38 times 10^{-8}}{1,38 times 10^{-23} times 100}
dfrac{N}{V} = dfrac{ 10^{-8}}{10^{-21}}
dfrac{N}{V} = 10^{13} ,moléculas/m3
Gabarito: LETRA C.
