Questões Sobre Termologia - Física - concurso
Questão 31
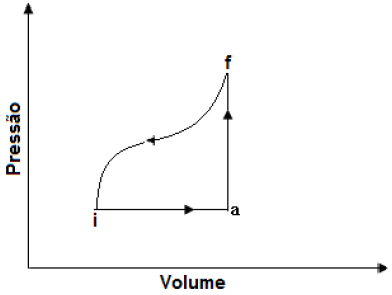
- A) -3 cal.
- B) 10 cal.
- C) 17 cal.
- D) -17 cal.
- E) -10 cal.
A alternativa correta é letra D) -17 cal.
Pessoal, sabemos que quando temos um ciclo fechado, a variação de energia interna é nula, independentemente dos caminhos.
Logo,
Delta U = (Q - W)_{iaf} + (Q - W)_{fi}
0 = 13 - 3 + Q_{if} + 7
Q = - 17 , cal
Gabarito: LETRA D.
Questão 32
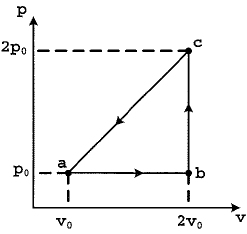
O diagrama p-v acima representa o ciclo a que é submetido um molde certo gás monoatómico ideal. Ao passar do estado b para o estado c, qual é a variação de energia interna desse gás em função da pressão p0 e do volume v0 ?
- A) 2povo
- B) 3povo
- C) 4poVo
- D) 6povo
- E) 8poVo
A alternativa correta é letra D) 6povo
Pessoal, podemos verificar a temperatura em cada ponto por meio de PV = n R T
Em b, teremos
P_b V_b = n R T_b
T_b = dfrac{2 P_0 V_0}{n R}
Em C,
T_c = dfrac{2 P_0 times 2 V_0}{n R} = dfrac{4 P_0 V_0}{n R}
Agora, vamos verificar a variação de energia interna para um gás monoatômico.
Delta U = dfrac{3}{2} n R Delta T
Delta U = dfrac{3}{2} n Rtimes (dfrac{4 P_0 V_0}{n R} - dfrac{2 P_0 V_0}{n R})
Delta U = dfrac{3}{2} times (4 P_0 V_0 - 2 P_0 V_0)
Delta U = 6 P_0 V_0
Gabarito: LETRA D.
33) Considere dois gases ideais A e B, na mesma temperatura, cujas respectivas partículas tenham massas mA = m e mB = 4m. Qual é a razão { large V_Aover V_B} entre as velocidades médias dessas partículas?
- A) ^1/_4
- B) ^1/_2
- C) 1
- D) 2
- E) 4
A alternativa correta é letra D) 2
Pessoal, a velocidade média de uma partícula é dada por
v = sqrt { dfrac{3kt}{m}}
Relacionando a velocidade dos dois, vamos ter,
dfrac{v_A}{v_B} = dfrac{sqrt { dfrac{3kt}{m_A}}}{sqrt { dfrac{3kt}{m_B}}}
dfrac{v_A}{v_B} = sqrt {dfrac{m_B}{m_A}}
dfrac{v_A}{v_B} = sqrt {dfrac{4 m}{m}}
dfrac{v_A}{v_B} = 2
Gabarito: LETRA D.
34) Considere que certo gás ideal se expande de tal maneira que sua pressão P e seu volume V ficam de acordo com PV2 = constante. Pode-se afirmar que, com relação aos valores iniciais de volume V0, pressão P0 e temperatura To, durante o processo de expansão na escala absoluta, a temperatura T
- A) diminui para { large T_o over 2} se o volume dobrar.
- B) permanece constante.
- C) aumenta para T_o^2
- D) diminui para { large T_o over sqrt{2}} , se o volume dobrar.
- E) aumenta para sqrt{2}T_o , quando a pressão diminui pela metade.
A alternativa correta é letra A) diminui para { large T_o over 2} se o volume dobrar.
Pessoal, vamos verificar afirmativa por afirmativa com base no que foi dado.
PV^2 = cte
a) diminui para { large T_o over 2} se o volume dobrar.
CORRETA.
Pessoal, reparem que quando o volume dobra, teremos
P times 4V = cte
Logo, a pressão tem que cair 4x para que se mantenha a relação. Ou seja, a pressão foi de P para P/4 enquanto o volume foi de V para 2V.
dfrac{PV}{T} = dfrac{P/4 times 2V}{T_f}
T_f = dfrac{T}{2}
Reparem que o que a questão nada mais quer que a relação de P por V dada seja atrelada a fórmula PV/T = cte.
Não vamos realizar as outras alternativas porque ficaria repetitiva a resolução.
Caso queira verificar, apenas jogue os valores que ele mencionar em P e V e depois coloque na fórmula PV/T para verificar que elas estão erradas.
Gabarito: LETRA A.
35) Seja um recipiente metálico fechado e contendo ar comprimido em seu interior. Considere desprezíveis as deformações no recipiente durante o experimento descrito a seguir: a temperatura do ar comprimido é aumentada de 24 °C para 40 °C. Sobre esse gás, é correto afirmar-se que
- A) sua pressão permanece constante, pois já se trata de ar comprimido.
- B) sua pressão aumenta.
- C) sua energia interna diminui, conforme prevê a lei dos gases ideais.
- D) sua energia interna permanece constante, pois o recipiente não muda de volume e não há trabalho realizado pelo sistema.
A alternativa correta é letra B) sua pressão aumenta.
Pela equação de Clapeyron temos que:
PV=nRT
Daí decorre que:
frac{PV}{T}=nR=constante
E portanto:
frac{PV}{T}=frac{P'V'}{T'} tag 1
Onde os termos (P,V,T),, text{e},, (P',V',T') representante as condições inicial e final da pressão, volume e temperatura do gás.
Conforme enunciado, podemos considerar que não houve alteração do volume do recipiente. A alteração de temperatura, em Kelvin foi de:
T_k=T_c+273
T_{k}=24+273=297
T'_{k}=40+273=313
Substituindo esses valores na equação 1 teremos:
frac{PV}{T}=frac{P'V'}{T'}
Como V=V':
frac{P}{297}=frac{P'}{313}
boxed{P'=313cdotfrac{P}{297}}
A consequência do aumento da temperatura do recipiente será o aumento da pressão final P', conforme demonstrado.
Gabarito: B
36) Considere um gás ideal que passa por dois estados, através de um processo isotérmico reversível. Sobre a pressão P e o volume V desse gás, ao longo desse processo, é correto afirmar-se que
- A) PV é crescente de um estado para outro.
- B) PV é constante.
- C) PV é decrescente de um estado para outro.
- D) PV é inversamente proporcional à temperatura do gás.
A alternativa correta é letra B) PV é constante.
Pela equação ideal dos gases, temos que:
frac{PV}{T}=nR=constante
Vamos chamar cada um dos estados do sistema de (1) e (2), então:
frac{P_1V_1}{T_1}=frac{P_2V_2}{T_2}
Como o processo é isotérmico, termos que T_1=T_2. Então:
P_1V_1=P_2V_2
Portanto, neste processo isotérmico, o produto pressão por volume sempre terá o mesmo valor.
Gabarito: B
Questão 37
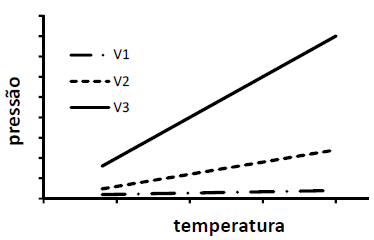
Assim, a relação entre os volumes é
- A) V1 = V2 > V3.
- B) V1 > V2 > V3.
- C) V1 = V2 < V3.
- D) V1 = V2 = V3.
A alternativa correta é letra B) V1 > V2 > V3.
Gabarito: LETRA B.
Para analisar a relação entre os volumes das três amostras de gás ideal, é importante entender como a pressão varia com a temperatura em um gás ideal.
De acordo com a lei geral dos gases ideais, essa relação é dada por:
dfrac { P cdot V } { T } = text{constante}
Onde P é a pressão, V é o volume T a temperatura do gás ideal. Manipulando a equação acima, podemos escrever:
dfrac { P cdot V } { T } = c
P = dfrac c V cdot T
Note que a equação acima estabelece uma relação linear entre a pressão e a temperatura de um gás ideal a um volume constante, ou seja, a equação que representa a pressão em função da temperatura é igual à equação y = mx de uma reta, como nos mostra a figura do enunciado.
Além disso, a razão m = dfrac c V representa o coeficiente angular da reta. Isso significa que quanto mais inclinada, maior o coeficiente angular da reta e, como o volume é inversamente proporcional a esse coeficiente, menor é o volume. Com isso, podemos afirmar que, quanto mais inclinada a reta PxT, menor é o volume do gás ideal.
Observando a figura do enunciado, podemos verificar que a inclinação da amostra 3 (linha cheia) é mais inclinada que a da amostra 2 (linha tracejada), que é mais inclinada que a da amostra 1 (traço e ponto). Então, a relação entre os volumes é a inversa, ou seja:
V_3 lt V_2 lt V_1
Ou, ainda,
V_1 gt V_2 gt V_3
Portanto, a resposta correta é a alternativa (b).
Questão 38
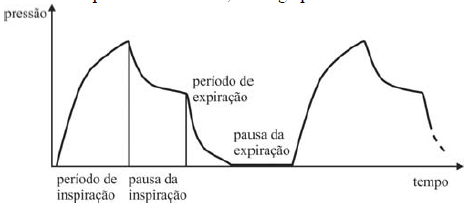
Internet: <www.livemedical.net/respiratory-mechanics> (com adaptações).
Entre as opções a seguir, assinale a que melhor representa o ciclo de ventilação descrito acima.
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra E)
Vamos analisar o que acontece no ciclo de ventilação pulmonar com as variáveis pressão e volume:
(1) Na primeira parte do ciclo, no período de inspiração, a pressão interna inicial dos pulmões parte de um valor mínimo e então, ocorre elevação gradativa da pressão interna e do volume dos pulmões. Isso é representado por uma curva ascendente no plano P x V.
(2) Assim que o pulmão atinge sua capacidade máxima, inicia-se um período de pausa no qual ocorre a diminuição de pressão a volume constante. Isso é representado por uma reta perpendicular, apontando para baixo, no plano P x V.
(3) Após o período de pausa, inicia-se o período de expiração, no qual ocorre a diminuição do volume e da pressão interna. Aqui, a pressão interna do pulmão atinge novamente o nível mínimo de pressão da etapa (1) e então o processo volta a se repetir. Isso é representado por uma curva inclinada para baixo e apontando para a esquerda no plano P x V.
Analisando todas as alternativas, concluímos que o gráfico que melhor representa a descrição do ciclo de ventilação pulmonar é a letra E.
Gabarito: E
39) Um aluno resolveu pôr em prática o que havia aprendido sobre gases e a primeira lei da termodinâmica em sua escola. Chegando à sua casa, ele pegou um saco plástico de cor preta e o encheu com ar até a metade do seu volume; em seguida, vedou o saco de forma que não fosse permitida a troca de matéria entre o interior e o exterior do saco plástico. O aluno observou que, no início, nada tinha ocorrido, mas, após algumas horas, exposto ao sol, o saco plástico tinha o seu volume ocupado por completo.
- A) F; F; F; F.
- B) V; F; F; V.
- C) V; F; V; V.
- D) V; F; F; F.
- E) F; V; V; F.
A alternativa correta é letra D) V; F; F; F.
Caso especificasse que a temperatura se manteve constante, o item estaria correto. Mas é perfeitamente possível que a quantidade de calor recebida seja utilizada tanto para realizar trabalho quanto para aumentar a energia interna do sistema
Em minha opinião o item está falso, embora a banca o tenha considerado verdadeiro, considerando que todo calor recebido é transformado em trabalho, aumentando o volume.
Falso. Como há aumento do volume, o trabalho é positivo.
Item falso.
Processo seria adiabático se não houvesse troca de calor com o meio externo.
O item está falso, pois o sistema recebem calor do meio externo.
Item falso.
Falso. O enunciado diz que não existe troca de matéria entre o interior e o exterior. O ar existente inicialmente ocupa maior volume devido à maior agitação das moléculas.
Item falso.
Não há item correto (gabarito: A), sendo que a banca considerou a letra A como a única alternativa correta.
Gabarito: Letra A.
40) As grandezas físicas temperatura e calor são diferentes, no entanto em conversas cotidianas, às vezes se confundem. Um estudante que tem dúvidas a respeito das diferenças entre estes dois conceitos elaborou a seguinte frase: “Quando um líquido, preso em um recipiente com pressão constante, recebe calor, a sua temperatura aumenta, e quando perde calor a sua temperatura diminui.”
- A) incorreta, pois apesar da temperatura ser proporcional a energia cinética das moléculas, ela não sofrerá variação enquanto a pressão for mantida constante.
- B) incorreta, pois apesar do calor ser uma forma de energia, as moléculas, ao trocarem calor, podem mudar de estado físico com a temperatura constante.
- C) correta, pois quando as moléculas presas em um recipiente fechado trocam calor, ocupam um volume constante e não sofrem variação de temperatura .
- D) correta, pois a temperatura será tanto maior quanto maior for a energia potencial das moléculas e esta aumenta quando uma substância recebe calor.
A alternativa correta é a letra C).
A afirmação do estudante está correta. Quando um líquido, em um recipiente com pressão constante, recebe calor, a sua temperatura aumenta, e quando perde calor, a sua temperatura diminui. Isso ocorre porque o calor é uma forma de energia que é transferida entre os corpos, e quando um líquido recebe calor, as moléculas ganham energia cinética e começam a se mover mais rapidamente, aumentando a temperatura. Já quando perde calor, as moléculas perdem energia cinética e começam a se mover mais lentamente, diminuindo a temperatura.
É importante notar que a temperatura e o calor são conceitos diferentes. A temperatura é uma medida da energia cinética das moléculas de um corpo, enquanto o calor é uma forma de energia que é transferida entre os corpos. Embora estejam relacionados, não são a mesma coisa.
A alternativa A está incorreta porque, embora a temperatura seja proporcional à energia cinética das moléculas, ela não sofre variação enquanto a pressão for mantida constante.
A alternativa B está incorreta porque, embora as moléculas possam mudar de estado físico com a temperatura constante, isso não é o que está sendo descrito na afirmação do estudante.
A alternativa D está incorreta porque, embora a temperatura seja tanto maior quanto maior for a energia potencial das moléculas, e esta aumente quando uma substância recebe calor, não é isso que está sendo descrito na afirmação do estudante.





