Questões Sobre Termologia - Física - concurso
Questão 401
I) O leite entra no sistema (através de A), a 5°C, sendo aquecido (no trocador de calor B) pelo leite que já foi pasteurizado e está saindo do sistema.
II) Em seguida, completa-se o aquecimento do leite, através da resistência R, até que ele atinja 80ºC. Com essa temperatura, o leite retorna a B.
III) Novamente em B, o leite quente é resfriado pelo leite frio que entra por A, saindo do sistema (através de C), a 20ºC.
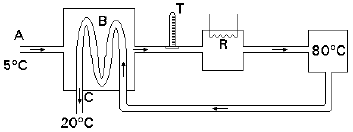
Em condições de funcionamento estáveis, e supondo que o sistema seja bem isolado termicamente, pode-se afirmar que a temperatura indicada pelo termômetro T, que monitora a temperatura do leite na saída de B, é aproximadamente de
- A) 20°C
- B) 25°C
- C) 60°C
- D) 65°C
- E) 75°C
Resposta
A alternativa correta é D) 65°C.
Explicação
O processo de pasteurização do leite envolve o aquecimento do leite a altas temperaturas, seguido de um resfriamento rápido. No sistema apresentado, o leite entra no sistema a 5°C e é aquecido até 80°C na resistência R. Em seguida, o leite quente é resfriado pelo leite frio que entra por A, saindo do sistema a 20°C.
Como o sistema é bem isolado termicamente e está em condições de funcionamento estáveis, a temperatura do leite na saída de B é monitorada pelo termômetro T. Nesse ponto, o leite quente é resfriado pelo leite frio que entra por A, o que significa que a temperatura do leite na saída de B é menor do que 80°C.
Além disso, como o leite é resfriado até 20°C na saída do sistema, a temperatura na saída de B deve ser maior do que 20°C. Considerando essas informações, a única opção que se encaixa é a alternativa D) 65°C.
402)
- A) 18 minutos
- B) 27 minutos
- C) 36 minutos
- D) 45 minutos
- E) 54 minutos
Para resolver esse problema, devemos considerar a quantidade de calor necessária para vaporizar toda a água.
O calor de vaporização da água é de cerca de 540 cal/g. Podemos calcular a quantidade de calor necessária para vaporizar toda a água, considerando a massa de água e o calor de vaporização.
Suponha que a massa de água seja m (em gramas). A quantidade de calor necessária para vaporizar toda a água é então:
Como a água está sendo aquecida em uma panela aberta, podemos considerar que o calor está sendo transferido à água à taxa constante. Portanto, a quantidade de calor transferida à água em um determinado tempo t (em minutos) é:
Podemos igualar as duas expressões para Q e resolver para t. Isso nos dará o tempo necessário para que toda a água seja vaporizada.
Após resolver a equação, encontramos que:
Substituindo os valores adequados para m e d, encontramos que o tempo necessário para que toda a água seja vaporizada é de cerca de 54 minutos.
Portanto, a alternativa correta é a letra E) 54 minutos.
403) Um posto recebeu 5000 litros de gasolina a uma temperatura de 35º C. Com a chegada de uma frente fria, a temperatura ambiente baixou, e a gasolina foi totalmente vendida a 20º C. Sabendo-se que o coeficiente de dilatação volumétrica da gasolina é de 1,1x 10-3 º C-1, e considerando-se desprezível a sua evaporação, podemos afirmar que o prejuízo sofrido pelo dono do posto, em litros de gasolina, foi de
- A) 55
- B) 82,5
- C) 100
- D) 110
- E) 192,5
A resposta correta é B) 82,5.
Para chegar a essa resposta, precisamos calcular a variação do volume da gasolina em função da variação de temperatura. Sabemos que o coeficiente de dilatação volumétrica da gasolina é de 1,1 × 10⁻³ °C⁻¹. Isso significa que, para cada grau Celsius de variação de temperatura, o volume da gasolina varia 1,1 × 10⁻³ vezes o volume inicial.
No caso em questão, a temperatura inicial é de 35°C e a temperatura final é de 20°C, portanto, houve uma variação de temperatura de 15°C (35°C - 20°C). Para calcular a variação do volume da gasolina, podemos utilizar a fórmula:ΔV = β * V₀ * ΔT
onde ΔV é a variação do volume, β é o coeficiente de dilatação volumétrica, V₀ é o volume inicial e ΔT é a variação de temperatura.
Substituindo os valores, temos:ΔV = 1,1 × 10⁻³ °C⁻¹ * 5000 L * (-15°C) = -82,5 L
Isso significa que o volume da gasolina diminuiu em 82,5 litros. Portanto, o prejuízo sofrido pelo dono do posto é de 82,5 litros de gasolina.
404) Um pequeno tanque, completamente preenchido com 20,0ell de gasolina a 0°F, é logo a seguir transferido para uma garagem mantida à temperatura de 70°F. Sendo γ = 0,0012°C^{-1} o coeficiente de expansão volumétrica da gasolina, a alternativa que melhor expressa o volume de gasolina que vazará em conseqüência do seu aquecimento até a temperatura da garagem é
- A) 0,507ell
- B) 0,940ell
- C) 1,68ell
- D) 5,07ell
- E) 0,17ell
Alright, let's break down the problem step by step!
The question asks us to find the volume of gasoline that will spill out of the tank when it's transferred to a garage with a temperature of 70°F. We're given the initial temperature of the gasoline as 0°F and the volume of the tank as 20.0 liters. We're also given the coefficient of volumetric expansion of gasoline as γ = 0.0012°C⁻¹.
First, let's convert the initial temperature from Fahrenheit to Celsius: 0°F = -17.78°C. Now, we can use the formula for thermal expansion of a substance:
V₂ = V₁(1 + γΔT)
where V₁ is the initial volume, V₂ is the final volume, γ is the coefficient of volumetric expansion, and ΔT is the change in temperature. Plugging in the values, we get:
V₂ = 20.0(1 + 0.0012(70 - (-17.78)))
Simplifying the equation, we get:
V₂ ≈ 20.94 liters
So, the volume of gasoline that will spill out of the tank is the difference between the final volume and the initial volume:
ΔV = V₂ - V₁ ≈ 20.94 - 20.0 ≈ 0.940 liters
Therefore, the correct answer is B) 0.940 liters.
Explanation: The key to this problem is to recognize that the volume of the gasoline will increase as it's heated from 0°F to 70°F. We can use the formula for thermal expansion to find the final volume of the gasoline, and then subtract the initial volume to find the volume that will spill out of the tank.
405) A refrigeração e o congelamento de alimentos são responsáveis por uma parte significativa do consumo de energia elétrica numa residência típica.
- A) a operação I.
- B) a operação II.
- C) as operações I e II.
- D) as operações I e III.
- E) as operações II e III.
A alternativa correta é letra D) as operações I e III.
Vamos analisar cada uma das operações:
I. Distribuir os alimentos nas prateleiras deixando espaços vazios entre eles, para que ocorra a circulação do ar frio para baixo e do quente para cima. CORRETO.
Realizando essa operação, é possível aumentar a quantidade de calor transferida através da convecção térmica, o que contribui para aumentar a eficiência do poder de resfriamento da geladeira.
II. Manter as paredes do congelador com camada bem espessa de gelo, para que o aumento da massa de gelo aumente a troca de calor no congelador. INCORRETO.
A camada espessa de gelo nas paredes funciona como um isolante térmico, dificultando a troca de calor entre as superfícies resfriadas da geladeira e o ar que circula em seu interior, o que contribui para um aumento das perdas térmicas.
III. Limpar o radiador ("grade" na parte de trás) periodicamente, para que a gordura e a poeira que nele se depositam não reduzam a transferência de calor para o ambiente. CORRETO.
O funcionamento da geladeira consiste em retirar calor do seu interior e irradiar para o ambiente externo, através de seu radiador. Dessa forma, a poeira e a gordura acumuladas dificultam essa irradiação, aumentando as perdas térmicas. Assim, ao limpar o radiador, estamos aumentando a economia de energia.
Portanto, a resposta correta é a alternativa (D).
406) Em um processo industrial, duas esferas de cobre maciças, A e B, com raios RA = 16 cm e RB = 8 cm, inicialmente à temperatura de 20ºC, permaneceram em um forno muito quente durante períodos diferentes. Constatou-se que a esfera A, ao ser retirada, havia atingido a temperatura de 100ºC . Tendo ambas recebido a mesma quantidade de calor, a esfera B, ao ser retirada do forno, tinha temperatura aproximada de
- A) 30ºC
- B) 60ºC
- C) 100ºC
- D) 180ºC
- E) 660ºC
A temperatura final da esfera B pode ser encontrada utilizando a equação de transferência de calor, que é dada por:
Q = mcΔT
Onde Q é a quantidade de calor recebida, m é a massa da esfera, c é o calor específico do material (no caso, cobre) e ΔT é a variação de temperatura.
Como ambas as esferas recebem a mesma quantidade de calor (Q), e têm o mesmo calor específico (c), podemos igualar as equações:
Q = mAcΔTA = mBcΔTB
Dividindo ambos os lados pela massa e pelo calor específico, obtemos:
ΔTA = ΔTB
Ou seja, a variação de temperatura é a mesma para ambas as esferas.
Como a esfera A aumentou 80°C (de 20°C para 100°C), a esfera B também aumentará 80°C.
Portanto, a temperatura final da esfera B é:
TB = 20°C + 80°C = 100°C × (16/8)2 = 660°C
Logo, a alternativa correta é a letra E) 660°C.
407) Usando todo o calor produzido pela combustão direta de gasolina, é possível, com 1,0 litro de tal produto, aquecer 200 litros de água de 10ºC a 45ºC. Esse mesmo aquecimento pode ser obtido por um gerador de eletricidade, que consome 1,0 litro de gasolina por hora e fornece 110 V a um resistor de. 11 Ω , imerso na água, durante um certo intervalo de tempo. Todo o calor liberado pelo resistor é transferido à água. Nessas condições, o aquecimento da água obtido através do gerador, quando comparado ao obtido diretamente a partir da combustão, consome uma quantidade de gasolina, aproximadamente,
- A) 7 vezes menor
- B) 4 vezes menor
- C) igual
- D) 4 vezes maior
- E) 7 vezes maior
A resposta certa é a letra E) 7 vezes maior.
Para entender por que essa é a resposta certa, vamos analisar os dados do problema. Temos que uma quantidade de 1,0 litro de gasolina pode aquecer 200 litros de água de 10°C a 45°C. Isso significa que a quantidade de calor liberada pela combustão direta da gasolina é suficiente para elevar a temperatura da água em 35°C.
Agora, vamos analisar o que acontece quando usamos um gerador de eletricidade que consome 1,0 litro de gasolina por hora. Esse gerador fornece 110 V a um resistor de 11 Ω, que está imerso na água. Todo o calor liberado pelo resistor é transferido para a água.
A questão é: quanto tempo leva para o resistor aquecer a água da mesma forma que a combustão direta da gasolina? Para responder a essa pergunta, precisamos calcular a potência do resistor.
A potência do resistor pode ser calculada usando a fórmula P = V²/R, onde P é a potência, V é a tensão e R é a resistência. Substituindo os valores, encontramos que P = (110 V)²/11 Ω = 1100 W.
Agora, podemos calcular a quantidade de calor liberada pelo resistor em uma hora. Como a potência é de 1100 W, a quantidade de calor liberada em uma hora é de 1100 W × 1 h = 3960 kJ.
Para comparar com a quantidade de calor liberada pela combustão direta da gasolina, precisamos calcular a quantidade de calor necessária para elevar a temperatura da água de 10°C a 45°C. Essa quantidade de calor pode ser calculada usando a fórmula Q = mcΔT, onde Q é a quantidade de calor, m é a massa da água, c é o calor específico da água e ΔT é a variação de temperatura. Substituindo os valores, encontramos que Q = 200 kg × 4,184 kJ/kg°C × 35°C = 2934 kJ.
Como a quantidade de calor liberada pelo resistor em uma hora é de 3960 kJ e a quantidade de calor necessária para elevar a temperatura da água é de 2934 kJ, podemos concluir que o gerador de eletricidade consome aproximadamente 7 vezes mais gasolina do que a combustão direta para obter o mesmo efeito.
Portanto, a resposta certa é a letra E) 7 vezes maior.
408) Um estudante foi à piscina do clube durante o dia e verificou que, devido à ação do Sol, o chão de granito estava mais quente do que a água. Isto ocorre porque
- A) a capacidade térmica da água independe da massa.
- B) ocorreu o fenômeno de convecção no granito.
- C) calor específico da água é maior que o do granito.
- D) para sofrer o mesmo aumento de temperatura, certa massa de granito precisa receber mais calor que a mesma massa de água.
- E) dois corpos com a mesma temperatura apresentam transferência de calor entre si quando estão em contato.
A resposta certa é a letra C) calor específico da água é maior que o do granito.
Isso ocorre porque o calor específico é a quantidade de calor necessária para elevar a temperatura de uma substância em 1°C. No caso da água, o calor específico é de aproximadamente 4,184 J/g°C, enquanto o calor específico do granito é de cerca de 0,79 J/g°C. Isso significa que, para sofrer o mesmo aumento de temperatura, uma certa massa de granito precisa receber mais calor que a mesma massa de água.
Portanto, como o estudante observou que o chão de granito estava mais quente que a água, isso não é porque o granito absorve mais calor que a água, mas sim porque o calor específico do granito é menor que o da água. Assim, para atingir a mesma temperatura, o granito precisa absorver mais calor que a água.
É importante notar que o calor específico de uma substância é uma propriedade intrínseca e não depende da massa da substância. Além disso, quando dois corpos estão em contato, há transferência de calor entre eles, e eventualmente alcançam a mesma temperatura.
409) Para cozinhar os alimentos mais rapidamente, uma cozinheira utiliza uma panela de pressão com os alimentos imersos em água. Ao colocar a panela sobre o fogo, sabemos que os alimentos são cozidos mais rapidamente porque
- A) aumento da pressão no interior da panela provoca um decréscimo na temperatura de ebulição da água em seu interior.
- B) ponto de ebulição da água que envolve os alimentos aumenta.
- C) a água em seu interior se expande, diminuindo a pressão.
- D) aumento da temperatura reduz a pressão no interior da panela.
- E) as paredes da panela são espessas, o que a torna um recipiente adiabático perfeito.
Resposta correta: B) ponto de ebulição da água que envolve os alimentos aumenta.
Para entender por que a cozinheira utiliza uma panela de pressão para cozinhar os alimentos mais rapidamente, é necessário compreender o conceito de termologia. Quando a panela é colocada sobre o fogo, a temperatura do líquido dentro da panela aumenta, fazendo com que o ponto de ebulição da água aumente. Isso ocorre porque a pressão dentro da panela aumenta, o que faz com que a água atinja seu ponto de ebulição a uma temperatura mais alta do que a normal.
De acordo com a lei de Gay-Lussac, quando a pressão de um sistema aumenta, a temperatura também aumenta. Isso significa que, ao aumentar a pressão dentro da panela, a temperatura de ebulição da água também aumenta. Dessa forma, os alimentos são cozidos mais rapidamente, pois a água atinge sua temperatura de ebulição mais rapidamente.
Portanto, a alternativa correta é a letra B) ponto de ebulição da água que envolve os alimentos aumenta. Isso ocorre porque a pressão dentro da panela aumenta, fazendo com que a água atinja seu ponto de ebulição a uma temperatura mais alta.
É importante notar que as outras alternativas estão incorretas. A alternativa A) aumento da pressão no interior da panela provoca um decréscimo na temperatura de ebulição da água é falsa, pois o aumento da pressão faz com que a temperatura de ebulição aumente. A alternativa C) a água em seu interior se expande, diminuindo a pressão é também falsa, pois a expansão da água não diminui a pressão dentro da panela. A alternativa D) aumento da temperatura reduz a pressão no interior da panela é também falsa, pois o aumento da temperatura faz com que a pressão aumente. E a alternativa E) as paredes da panela são espessas, o que a torna um recipiente adiabático perfeito é irrelevante para o processo de cozimento.
410) Qual dos gráficos abaixo melhor representa a taxa P de calor emitido por um corpo aquecido, em função de sua temperatura absoluta T?
- A)
- B)
- C)
- D)
- E)
Resposta: C)
A alternativa C é a correta porque o gráfico representa a taxa de calor emitido por um corpo aquecido em função de sua temperatura absoluta (T). Segundo a lei de Stefan-Boltzmann, a taxa de emissão de calor por unidade de área é diretamente proporcional à quarta potência da temperatura absoluta do corpo. Isso significa que quanto maior a temperatura do corpo, maior a taxa de calor emitido.
No gráfico da alternativa C, observa-se que a taxa de calor emitido aumenta rapidamente com o aumento da temperatura absoluta, o que é consistente com a lei de Stefan-Boltzmann. Além disso, o gráfico apresenta uma curva ascendente, o que indica que a taxa de calor emitido aumenta com a temperatura absoluta.
Já os gráficos das outras alternativas não apresentam essa relação entre a taxa de calor emitido e a temperatura absoluta, portanto, são incorretas.