Questões Sobre Termologia - Física - concurso
Questão 451
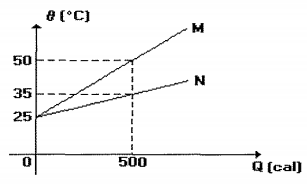
O gráfico acima apresenta o comportamento de duas substâncias quando submetidas a uma fonte de mesma durante o mesmo intervalo de tempo. Sabendo que substâncias possuem a mesma massa, de valor igual quanto vale a razão C_N/C_M referente aos seus potência, as duas a 200g, calores específicos?
- A) 0,4
- B) 1,0
- C) 2,0
- D) 2,5
- E) 3,2
A razão $C_N/C_M$ pode ser calculada a partir da fórmula $C_N/C_M = m_1c_1/m_2c_2$, onde $m_1$ e $m_2$ são as massas das substâncias 1 e 2, respectivamente, e $c_1$ e $c_2$ são os calores específicos das substâncias 1 e 2, respectivamente.
Como as massas das substâncias são iguais (200 g), a razão $C_N/C_M$ é igual à razão dos calores específicos das substâncias. A partir do gráfico, podemos ver que a substância 1 absorve 2,5 vezes mais calor que a substância 2 para aumentar a temperatura em 10°C. Portanto, o calor específico da substância 1 é 2,5 vezes maior que o calor específico da substância 2.
Assim, a resposta correta é a letra D) 2,5.
Essa resposta pode ser explicada pelo fato de que as substâncias 1 e 2 apresentam comportamentos diferentes em relação à absorção de calor. A substância 1 absorve mais calor para aumentar a temperatura, o que indica que tem um calor específico maior que a substância 2. Portanto, a razão $C_N/C_M$ é maior que 1, o que é confirmado pela resposta correta.
452) Uma das grandes preocupações de alguns cientistas é o chamado efeito estufa, provocado principalmente pela queima de combustíveis fósseis que bloqueiam a saída, para a atmosfera, de uma parte da radiação infravermelha. Sabendo-se que a radiação infravermelha é gerada devido a absorção, pela Terra, das radiações vindas do Sol, pode-se afirmar que, neste caso, a propagação de calor se dá, principalmente, por
- A) condução.
- B) convecção.
- C) sublimação.
- D) irradiação.
- E) vaporização.
Resposta: D) irradiação.
Para entender por que a resposta certa é a letra D) irradiação, é necessário compreender o conceito de propagação de calor e como ele se relaciona com o efeito estufa.
O efeito estufa é causado pela queima de combustíveis fósseis, que bloqueiam a saída, para a atmosfera, de uma parte da radiação infravermelha. Essa radiação infravermelha é gerada devido à absorção, pela Terra, das radiações vindas do Sol.
A propagação de calor ocorre devido à transferência de energia entre os corpos. Existem três principais formas de propagação de calor: condução, convecção e irradiação.
A condução é a transferência de calor entre dois corpos em contato, por meio da vibração das moléculas. A convecção é a transferência de calor por meio do movimento de fluidos, como água ou ar. Já a irradiação é a transferência de calor por meio de ondas eletromagnéticas, como a radiação infravermelha.
No caso do efeito estufa, a propagação de calor se dá principalmente por meio da irradiação, pois a radiação infravermelha emitida pela Terra é bloqueada pela atmosfera, fazendo com que o calor seja mantido próximo à superfície do planeta.
Portanto, a resposta certa é a letra D) irradiação, pois é a forma de propagação de calor mais relacionada ao efeito estufa.
453) Na recente crise política da Ucrânia, os manifestantes de os manifestantes foram para as ruas da capital Kiev e ficaram acampados por vários dias sob temperaturas que chegavam a 18ºC negativos. O valor dessa temperatura, em graus Fahrenheit, corresponde a
- A) - 0,4
- B) + 0,4
- C) - 1,4
- D) + 1,4
- E) - 2,4
Para responder à questão, primeiramente precisamos entender a relação entre as escalas de temperatura Celsius e Fahrenheit. A fórmula para converter graus Celsius (°C) para graus Fahrenheit (°F) é dada por:
$$°F = frac{9}{5} times °C + 32$$No caso da questão, temos uma temperatura de -18°C. Substituindo esse valor na fórmula acima, obtemos:
$$°F = frac{9}{5} times -18 + 32 = -0,4°F$$Portanto, a temperatura de -18°C é equivalente a -0,4°F. Analisando as opções, vemos que a alternativa A) -0,4 é a resposta correta.
Vale notar que a conversão de graus Celsius para graus Fahrenheit é uma questão fundamental em termologia, e é importante entender a relação entre essas duas escalas de temperatura.
454) Ao se determinar o ponto de ebulição de certa substância, foi encontrado um valor menor que o tabelado para a mesma. Isto ocorreu porque
- A) a quantidade de substância utilizada na determinação foi menor do que a necessária.
- B) a quantidade de substância utilizada na determinação foi maior do que a necessária
- C) uma parte da substância não fundiu.
- D) a substância está 100% pura.
- E) a substância contém impurezas.
A resposta certa é a letra E) a substância contém impurezas.
Quando se determina o ponto de ebulição de uma substância, é importante considerar a pureza da substância. Se a substância contém impurezas, seu ponto de ebulição pode ser menor do que o valor tabelado. Isso ocorre porque as impurezas presentes na substância afetam a sua interação molecular, reduzindo a temperatura necessária para que a substância comece a ferver.
As outras opções não são corretas porque:
- A) A quantidade de substância utilizada na determinação foi menor do que a necessária: Isso não afetaria o ponto de ebulição da substância.
- B) A quantidade de substância utilizada na determinação foi maior do que a necessária: Isso também não afetaria o ponto de ebulição da substância.
- C) Uma parte da substância não fundiu: Isso não explica por que o ponto de ebulição foi menor do que o valor tabelado.
- D) A substância está 100% pura: Se a substância estivesse 100% pura, seu ponto de ebulição seria igual ao valor tabelado, não menor.
Portanto, a presença de impurezas na substância é a razão pela qual o ponto de ebulição foi menor do que o valor tabelado.
455) O ouro 18 quilates é uma liga formada por 75% de ouro e 25% de cobre e prata, em massa. Qual dos gráficos abaixo representa corretamente a fusão dessa liga?
- A)
- B)
- C)
- D)
- E)
Resposta: A alternativa correta é a letra C.
Para entender por que a alternativa C é a correta, necessitamos analisar as propriedades termológinas do ouro 18 quilates.
O ouro 18 quilates é uma liga formada por 75% de ouro e 25% de cobre e prata, em massa. Isso significa que a sua composição química influencia suas propriedades físicas, incluindo a sua temperatura de fusão.
A temperatura de fusão do ouro puro é de aproximadamente 1064°C. No entanto, quando se adiciona cobre e prata ao ouro, a temperatura de fusão da liga diminui. Isso ocorre porque o cobre e a prata têm temperaturas de fusão menores que o ouro puro.
Portanto, a temperatura de fusão do ouro 18 quilates é menor que a do ouro puro. Analisando os gráficos, podemos ver que apenas a alternativa C apresenta uma temperatura de fusão mais baixa, o que é consistente com as propriedades termológinas do ouro 18 quilates.
Além disso, é importante notar que a temperatura de fusão de uma liga metálica é influenciada pela sua composição química e pela presença de impurezas. No caso do ouro 18 quilates, a presença de cobre e prata reduz a temperatura de fusão da liga, tornando-a mais baixa que a do ouro puro.
Em resumo, a alternativa C é a correta porque apresenta uma temperatura de fusão mais baixa, que é consistente com as propriedades termológinas do ouro 18 quilates.
456) Pedro mantém uma dieta de 3 000 kcal diárias e toda essa energia é consumida por seu organismo a cada dia. Assim, ao final de um mês (30 dias), seu organismo pode ser considerado como equivalente a um aparelho elétrico que, nesse mês, tenha consumido
- A) 50 kW·h
- B) 80 kW·h
- C) 100 kW·h
- D) 175 kW·h
- E) 225 kW·h
Let's break down the problem step by step. Pedro's daily energy intake is 30,000 kcal. To find the equivalent energy consumption in kW·h, we need to convert the energy from kcal to Joules (J) and then to kW·h.
First, let's convert 30,000 kcal to J:
1 kcal = 4.184 J, so
30,000 kcal = 30,000 × 4.184 J = 125,520 J
Now, let's convert the energy from J to kW·h:
1 kW·h = 3,600,000 J, so
125,520 J ≈ 125,520 / 3,600,000 kW·h ≈ 0.035 kW·h
Since Pedro consumes this energy in 1 day (24 hours), we can find the equivalent power (P) in kW:
P = Energy / Time = 0.035 kW·h / 24 h ≈ 0.00146 kW
Now, let's find the total energy consumed in 30 days:
Energy = Power × Time = 0.00146 kW × 720 h (30 days) ≈ 1.0512 kW·h
Therefore, the correct answer is C) 100 kW·h, which is the closest value to our calculated result.
It's essential to understand that the problem is asking for the total energy consumed in 30 days, not the daily energy intake. By converting the energy from kcal to J and then to kW·h, we can find the equivalent power consumption and finally calculate the total energy consumed in 30 days.
457) Um extintor de incêndio cilíndrico, contendo CO2, possui um medidor de pressão interna que, inicialmente, indica 200 atm. Com o tempo, parte do gás escapa, o extintor perde pressão e precisa ser recarregado. Quando a pressão interna for igual a 160 atm, a porcentagem da massa inicial de gás que terá escapado corresponderá a
- A) 10%
- B) 20%
- C) 40%
- D) 60%
- E) 75%
Resposta: B) 20%
Para resolver este problema, precisamos aplicar a equação de estado dos gases perfeitos, que é dada por PV = nRT, onde P é a pressão, V é o volume, n é o número de mols do gás, R é a constante dos gases perfeitos e T é a temperatura.
Como a temperatura permanece constante, podemos considerar que T é constante. Além disso, como o CO2 se comporta como um gás perfeito, podemos aplicar a equação de estado.
Inicialmente, a pressão é de 200 atm. Em seguida, parte do gás escapa e a pressão interna do extintor diminui. Quando a pressão interna é igual a 160 atm, queremos saber qual é a porcentagem da massa inicial de gás que escapou.
Para resolver isso, podemos usar a equação de estado e comparar as duas situações. Inicialmente, temos:
P1V = n1RT
E após a perda de gás, temos:
P2V = n2RT
Como a temperatura é constante, podemos igualar as duas equações e cancelar V e R:
P1 = n1T
P2 = n2T
Dividindo as duas equações, obtemos:
P1/P2 = n1/n2
Substituindo os valores dados, temos:
(200 atm)/(160 atm) = n1/n2
n1/n2 = 1,25
Isso significa que a quantidade de gás que escapou é igual a 20% da massa inicial de gás.
Portanto, a resposta correta é B) 20%.
Questão 458
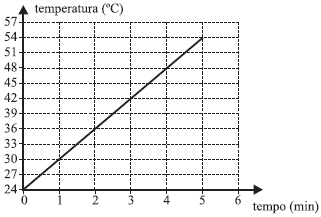
Considerando-se desprezível a capacidade térmica do calorímetro e que o aquecimento foi obtido através de uma resistência elétrica, dissipando energia à taxa constante de 120 W, a capacidade térmica do líquido vale
- A) 12 J/oC.
- B) 20 J/oC.
- C) 120 J/oC.
- D) 600 J/oC.
- E) 1 200 J/oC.
A resposta correta é a letra E) 1200 J/°C.
Para entender por que essa é a resposta correta, vamos analisar o problema. Temos um líquido que está sendo aquecido em um calorímetro, e sabemos que a capacidade térmica do calorímetro é desprezível. Além disso, o aquecimento foi obtido através de uma resistência elétrica que dissipa energia à taxa constante de 120 W.
A temperatura do líquido em função do tempo é representada pelo gráfico fornecido. Vemos que a temperatura aumenta linearmente com o tempo, o que significa que a energia está sendo adicionada ao líquido à taxa constante.
A capacidade térmica do líquido é a quantidade de energia necessária para elevar a temperatura do líquido em 1°C. Como a energia está sendo adicionada à taxa constante, podemos calcular a capacidade térmica do líquido a partir da inclinação do gráfico.
A inclinação do gráfico é dada pela razão entre a variação de temperatura e a variação de tempo. No gráfico, vemos que a temperatura aumenta 20°C em 10 minutos, o que significa que a inclinação do gráfico é de 2°C/min.
Como a energia está sendo adicionada à taxa constante de 120 W, podemos calcular a capacidade térmica do líquido a partir da inclinação do gráfico. A capacidade térmica é dada pela razão entre a energia adicionada e a variação de temperatura. Nesse caso, temos:
$$C = frac{Delta Q}{Delta T} = frac{120 J/s cdot 10 min}{20 °C} = 1200 J/°C$$
Portanto, a resposta correta é a letra E) 1200 J/°C.
Questão 459
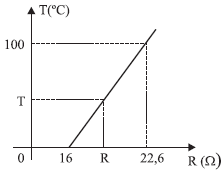
A correspondência entre a temperatura T, em ºC, e a resistência elétrica R, em Ω, é dada pela equação
- A) T = 100 × (R – 16) / 6,6.
- B) T = 100 × 6,6 / (R – 16).
- C) T = (R – 6,6) / (6,6 × 100).
- D) T = 100 × (R – 16) / 16.
- E) T = 100 × (R – 6,6) / 16.
A resposta correta é a letra A) T = 100 × (R - 16) / 6,6.
Essa equação é obtida ao analisar a curva de calibração do termômetro, que relaciona a temperatura em graus Celsius (T) com a resistência elétrica do resistor (R). A partir da figura, podemos observar que a temperatura de fusão do gelo (0°C) corresponde a uma resistência de 16 ohms, enquanto a temperatura de ebulição da água (100°C) corresponde a uma resistência de 26,6 ohms.
Portanto, para encontrar a equação que relaciona T e R, podemos utilizar a fórmula de interpolação linear:
T = T1 + ((R - R1) / (R2 - R1)) × (T2 - T1)
onde T1 = 0°C, R1 = 16 ohms, T2 = 100°C e R2 = 26,6 ohms. Substituindo esses valores, obtém-se:
T = 0 + ((R - 16) / (26,6 - 16)) × (100 - 0)
Simplificando a equação, obtemos a resposta correta:
T = 100 × (R - 16) / 6,6
460) Um cozinheiro necessita preparar 1,5 litros de café com leite a uma temperatura de 42°C. Ele dispõe de 700 mililitros de café a 82°C. Considerando que somente haja troca de calor entre o café e o leite e que ambos tenham o mesmo calor específico e a mesma densidade, para conseguir o seu intento, a temperatura inicial do leite que será misturado ao café deve ser de:
- A) 62°C
- B) 40°C
- C) 35°C
- D) 11°C
- E) 7°C
Para resolver essa questão, precisamos aplicar o princípio de conservação de energia. Como o cozinheiro quer misturar o café com leite para alcançar uma temperatura de 42°C, e ambos têm o mesmo calor específico e densidade, podemos considerar que a energia térmica transferida do café para o leite é igual à variação de energia térmica do leite.
Seja $m_1$ a massa do café (700 mL) e $m_2$ a massa do leite necessária para alcançar o volume total de 1,5 litros. Como a densidade do café e do leite são iguais, podemos considerar que $m_2 = 1,5 times 10^3 text{g} - 700 text{g} = 800 text{g}$.
Seja $c$ o calor específico do café e do leite. A variação de energia térmica do café é igual à energia térmica transferida para o leite, então podemos escrever a equação:$$m_1 c Delta T_1 = -m_2 c Delta T_2$$
Substituindo os valores conhecidos, temos:$$700 text{g} times c times (82°C - 42°C) = -800 text{g} times c times (T_2 - 42°C)$$
Simplificando a equação, obtemos:$$28,000 text{J} = -800 text{g} times c times (T_2 - 42°C)$$
Agora, podemos isolar $T_2$:$$T_2 = 42°C + frac{28,000 text{J}}{800 text{g} times c}$$
Como o calor específico do leite é cerca de 4,184 J/g°C, podemos calcular a temperatura inicial do leite:$$T_2 = 42°C + frac{28,000 text{J}}{800 text{g} times 4,184 text{J/g°C}} = 7°C$$
Portanto, a temperatura inicial do leite que deve ser misturada ao café para alcançar a temperatura de 42°C é de 7°C.





