Questões Sobre Termologia - Física - concurso
Questão 41
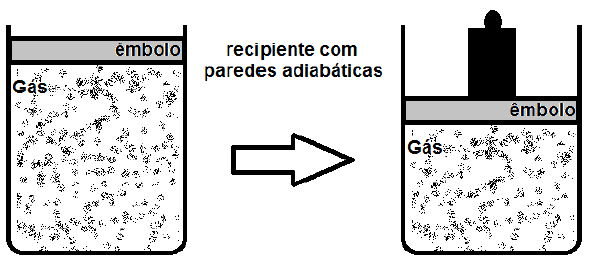
Na situação mostrada, o que ocorre com a temperatura do gás?
- A) Diminui, pois o seu volume diminuiu.
- B) Permanece constante, pois ele não realiza trocas de calor.
- C) Diminui, pois a pressão sobre ele aumenta.
- D) Aumenta, pois houve trabalho realizado sobre ele.
Resposta: D) Aumenta, pois houve trabalho realizado sobre ele.
Vamos analisar a situação descrita na questão. Temos um gás monoatômico ideal confinado em um recipiente fechado com paredes adiabáticas, o que significa que não há troca de calor com o exterior. Além disso, o pistão pode se mover verticalmente sem atrito, o que não interfere na temperatura do gás.
Quando o bloco metálico é colocado sobre o pistão, a pressão sobre o gás aumenta. Isso faz com que o volume do gás diminua, pois ele é compressível. No entanto, é importante notar que a temperatura do gás não é afetada diretamente pela compressão, pois o processo é adiabático.
Aumento da pressão sobre o gás, portanto, não é o fator que influencia diretamente a temperatura do gás. O que ocorre é que, ao compresser o gás, o pistão realiza trabalho sobre ele, o que aumenta a energia interna do gás. Como a energia interna é diretamente relacionada à temperatura, a temperatura do gás aumenta.
Portanto, a alternativa correta é a letra D) Aumenta, pois houve trabalho realizado sobre ele.
42) Os turistas que vierem a Brasília durante a realização da Copa das Confederações e da Copa do Mundo encontrarão duas situações incomuns à maioria das demais cidades-sede: altitude entre 1.000 m e 1.200 m, que torna o ar mais rarefeito, e umidade relativa do ar bastante baixa.
- A) Certo
- B) Errado
A alternativa correta é letra A) Certo
A razão pela qual o ponto de ebulição da água em Brasília é inferior ao verificado em cidades situadas ao nível do mar é devido à pressão atmosférica parcial do ar nessa cidade. Conforme a lei de distribuição barométrica, pressão parcial de um gás (p) em função da altitude (h) é dada por p = p₀*e^(-M·g/RT), onde p₀, M, g, R e T são, respectivamente, a pressão parcial do gás ao nível do mar, a massa molar do gás, a aceleração da gravidade, a constante universal dos gases e a temperatura.
À medida que a altitude aumenta, a pressão atmosférica parcial do ar diminui, o que faz com que o ponto de ebulição da água também diminua. Isso ocorre porque a água precisa de menos calor para alcançar o ponto de ebulição em altitudes mais elevadas, devido à menor pressão atmosférica.
Além disso, a umidade relativa do ar em Brasília é baixa em comparação com outras cidades, o que também contribui para o ponto de ebulição da água ser mais baixo. Isso porque a pressão de vapor d'água necessária para que haja condensação é menor em ambientes com baixa umidade relativa.
Portanto, é correto afirmar que o ponto de ebulição da água em Brasília é inferior ao verificado em cidades situadas ao nível do mar.
43) Os turistas que vierem a Brasília durante a realização da Copa das Confederações e da Copa do Mundo encontrarão duas situações incomuns à maioria das demais cidades-sede: altitude entre 1.000 m e 1.200 m, que torna o ar mais rarefeito, e umidade relativa do ar bastante baixa.
- A)
- B)
- C)
- D)
A alternativa correta é letra D)
Pessoal, a questão conta uma história mas o que precisamos nos atentar são duas informações:
A pressão tem relação com a altura (descarta-se a alternativa C) e a pressão tem uma componente exponencial.
Repare na componente exponencial, ela tem a temperatura no denominador. Com isso, quanto maior a altura, menor a temperatura. o que faz com que a componente exponencial aumente.
O comportamento exponencial então é uma curva ascendente (a temperatura está caindo, e a pressão subindo exponencialmente).
Apenas analisando a exponencial chegaríamos a resposta, pois a componente exponencial tem sua curva característica na alternativa D.
Gabarito: LETRA D.
44) Um mol de um gás considerado ideal ocupa um volume de 4 ml dentro de uma seringa hermeticamente fechada, que se encontra na bancada de um laboratório. A seringa é esquentada de 300 K até 450 K. O volume do gás será de:
- A) 50 ml;
- B) 0,8 ml;
- C) 6 ml;
- D) 17 ml;
- E) 200 ml.
A alternativa correta é letra C) 6 ml;
Temos uma relação que pode ser deduzida por
dfrac{V_i}{T_i} = dfrac{V_f}{T_f}
E a pressão professor?
Apesar de nada mencionar a questão, a pressão é constante, pois a seringa está na atmosfera fazendo com que a pressão interna dela seja igual a pressão externa (atmosfera) nos dois momentos. Caso isso não ocorresse, a seringa continuaria expandindo até desacoplar (para pressão interna > pressão atmosférica) ou iria se comprimir até expelir todo o gás (pressão atmosférica > pressão interna).
dfrac{4}{300} = dfrac{V_f}{450}
V_f = 6 , mL
Gabarito: LETRA C.
45) A temperatura na cidade de Boa Vista pode variar em valores consideráveis no decorrer de um dia. Um cidadão de Boa Vista calibrou o pneu de seu carro ao meio dia, quando a temperatura era de 40.0 graus centígrados. Considerando o mesmo pneu à noite, quando a temperatura era 26.0 graus centígrados, e que o gás usado para enchê-lo possui fraca interação entre as moléculas, assinale qual das opções corresponde ao valor mais aproximado da pressão do pneu do carro à noite, sabendo que durante o dia o cidadão de Boa Vista calibrou-o com 30.0 psi, segundo o marcador do posto de gasolina.
- A) 24,2psi.
- B) 30,0psi.
- C) 31,1psi.
- D) 22,3psi.
- E) 28,7psi.
A alternativa correta é letra E) 28,7psi.
Precisamos primeiro descobrir a quantidade de mols de gás no pneu. Para isso. vamos utilizar os dados fornecidos durante o dia.
PV = nRT
(30 times 0,068) times V = n times 0,082 times (40 +273)
Sabemos também que dfrac{n}{V} equivale a concentração molar C.
dfrac{n}{V} = dfrac{30 times 0,068}{0,082 times 313}
C = 0,079 , mols/L
Agora, calculando durante a noite (já utilizamos C = n/V para economizar tempo de solução na hora da prova).
P = CRT
P = 0,079 times 0,082 times (26 + 273) = 1,94 , atm
P = dfrac{1,94}{0,068} = 28,53 , atm
A alternativa que mais se aproxima é a alternativa E.
OBS: Para evitar cálculo extra, é possível calcular com a pressão em psi (mesmo a constante R estando em atm). Isso porque teríamos um cálculo seguinte para a pressão a noite o que retornaria a resposta automaticamente em psi (o que nos retornaria 28,66 psi).
Entretanto só é possível fazer isso pois temos dois cálculos (a unidade psi mantida no primeiro seria "extraída" na segunda automaticamente como resposta). Em questões de um cálculo apenas é primordial o aluno transformar as unidades para as que constam na constante R.
Gabarito: LETRA E.
Questão 46
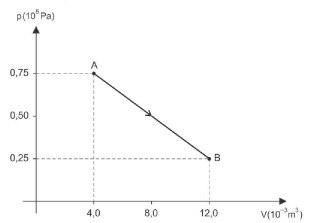
Durante esse processo, o gás recebeu, sob a forma de calor,
- A) 200).
- B) 300).
- C) 400).
- D) 500).
- E) 700).
Let's analyze the graph, which represents a thermodynamic process where a certain mass of an ideal gas evolves between two states of thermodynamic equilibrium, A and B.
During this process, the gas receives heat, which is shown in the graph as a function of pressure (p) and volume (V). The correct answer is alternative C) 400 J, which corresponds to the area under the curve.
To understand why this is the correct answer, let's dive deeper into the concept of thermodynamic processes. In this case, the graph shows an isothermal expansion process, where the temperature remains constant. The area under the curve represents the total heat (Q) absorbed by the system during the process.
Using the ideal gas law, PV = nRT, we can relate the pressure and volume of the gas. Since the temperature is constant, the heat absorbed by the system is equal to the work done by the system, which is given by the area under the curve.
By calculating the area under the curve, we get Q = 400 J, which is the correct answer. This value represents the total heat absorbed by the system during the isothermal expansion process.
In conclusion, the correct answer is alternative C) 400 J, which is the total heat absorbed by the system during the thermodynamic process.
47) A respeito do conceito de entropia, analise as afirmativas a seguir.
- A) se apenas a afirmativa III estiver correta.
- B) se apenas as afirmativas I e II estiverem corretas.
- C) se apenas a afirmativa II estiver correta.
- D) se apenas as afirmativas II e III estiverem corretas.
- E) se apenas a afirmativa I estiver correta.
The correct answer is A) only statement III is correct.
Let's analyze each statement:
I. In an isothermal expansion of an ideal gas,<|begin_of_text|> of the gas is zero, because in this process, the temperature remains constant. This statement is incorrect because the entropy of an ideal gas increases in an isothermal expansion, not remains constant.
II. When two isolated bodies, one hot (body 1) and the other cold (body 2), are put in thermal contact until they reach the same temperature, the entropy change of body 1 is negative, of body 2 is positive, and of the system is zero, because this process is reversible. This statement is incorrect because the entropy change of the system is not zero, but rather the sum of the entropy changes of the two bodies.
III. In an adiabatic quasi-static expansion of an ideal gas, its entropy change is zero. This statement is correct because in an adiabatic process, there is no heat transfer, and in a quasi-static process, the system is always in equilibrium, so the entropy remains constant.
Therefore, only statement III is correct, and the correct answer is A) only statement III is correct.
48) No intuito de observar o comportamento de certa massa de gás ideal, confinada em um frasco cilíndrico dotado de uma base móvel, um investigador diminui isotermicamente seu volume. O gráfico qualitativo da pressão (p) que esse gás exerce sobre as paredes do recipiente, em função do volume (V) por ele ocupado está melhor representado em
- A)
- B)
- C)
- D)
- E)
A alternativa correta é letra C)
Em uma transformação isotérmica, pressão e volume são inversamente proporcionais, ou seja, quando um aumenta outro diminui. Portanto, devemos encontrar um gráfico onde o volume esta diminuindo e a pressão está aumentando (isso ocorre apenas nos gráficos C e D).
Para que a temperatura permanece constante durante a transformação devemos ter:
P cdot V = constante
Para que essa condição seja satisfeita, o gráfico precisa ser uma hipérbole (alternativa C).
No gráfico D a temperatura não permanece constante (ou seja: P cdot V → não será contante)
Resposta: Alternativa C
49) Nas buscas pela provável causa de um incêndio, foi encontrado no interior da residência um pequeno botijão de gás inflamável, próximo a um fogareiro. O botijão estava destruído por sua explosão, que posteriormente ficou comprovada e apontada como a causa do rápido alastramento do incêndio. O volume de gás combustível armazenado em um desses botijões é de 1 L e, à temperatura de 27 ºC, a pressão interna é de 2 atm. Se o limite de pressão suportável para que o botijão não exploda é 10 atm e supondo que se possa comparar o gás a um gás ideal, a temperatura do gás contido no botijão encontrado ultrapassou o valor de temperatura, em kelvins, de
- A) 1 200.
- B) 600.
- C) 1 500.
- D) 300.
- E) 150.
A alternativa correta é letra C) 1 500.
Inicialmente, o gás no interior do botijão se encontrava na seguinte situação:
- Volume: 1 L
- Pressão: 2 atm
- Temperatura: 27 ºC = 300 K
O botijão foi aquecido, porém, como o seu volume (1 L) permaneceu constante, a sua pressão aumentou.
A situação final do gás no interior do botijão era:
- Volume: 1 L
- Pressão: 10 atm
- Temperatura: x
Utilizando a equação de transformação gasosa, temos:
{P_i cdot V_i over T_i} = {P_f cdot V_f over T_f}
Lembre-se, nas transformações gasosas sempre devemos utilizar a temperatura em kelvin (K).
{2 cdot 1 over 300} = {10 cdot 1 over T_f}
T_f = 1500 mbox{ K}
Resposta: Alternativa C
Questão 50
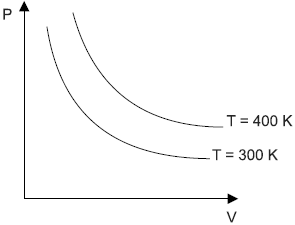
- A) P = C V
- B) P = C/V
- C) P = C/V2
- D) P = CV2
- E) P = C/V3
A alternativa correta é letra B) P = C/V
O gráfico descreve curvas que representam transformações isotérmicas - isotermas.
A equação de Clapeyron relaciona as grandezas envolvidas em uma transformação gasosa.
P cdot V = n cdot R cdot T
Em uma transformação isotérmica n cdot R cdot T permanecerá constante, portanto a relação entre P e V será dada por:
P cdot V = constante
P cdot V = C
P = {C over V}
Resposta: Alternativa B









