Questões Sobre Termologia - Física - concurso
571) Uma massa de gelo de 500 g, inicialmente a uma temperatura de 250 K, é colocada dentro de um recipiente de alumínio de 60 g, em equilíbrio térmico com o gelo. Então, é cedida a esse sistema uma quantidade de calor igual a 60570 Cal, enquanto a pressão é mantida constante. Considerando o ponto de fusão do gelo a 273 K, desprezando as trocas de calor do sistema com o ambiente e sabendo que o calor específico médio da água vale 1 cal/g.ºC, que o calor latente de fusão para o gelo é igual a 80 Cal/g, que o calor específico do gelo vale 0,5 cal/g.ºC e que o calor específico do alumínio é igual a 0,22 cal/g.ºC, ao final desse processo, obtém-se
- A) gelo a 273 K.
- B) água a 301,3 K.
- C) água a 305,2 K.
- D) 422 g de água e 78 g de vapor.
To solve this problem, we need to break it down into several stages. Initially, we have a 500g ice block at 250K, which is in thermal equilibrium with the 60g aluminum container. Then, 60570 cal of heat is added to the system while maintaining constant pressure. We need to find the final temperature of the system.
First, let's calculate the heat required to raise the temperature of the ice from 250K to 273K (its melting point). The specific heat of ice is 0.5 cal/g°C, so the heat required is:Q = mcΔT = 500g × 0.5 cal/g°C × (273K - 250K) = 1150 cal
Next, we need to calculate the heat required to melt the ice. The latent heat of fusion for ice is 80 cal/g, so:Q = mL = 500g × 80 cal/g = 40000 cal
Now, let's calculate the heat required to raise the temperature of the resulting water from 273K to its final temperature. We'll call this temperature T. The specific heat of water is 1 cal/g°C, so:Q = mcΔT = 500g × 1 cal/g°C × (T - 273K)
The heat required to raise the temperature of the aluminum container is:Q = mcΔT = 60g × 0.22 cal/g°C × (T - 273K)
The total heat added to the system is 60570 cal, which is equal to the sum of the heats required for the above three stages:60570 cal = 1150 cal + 40000 cal + 500g × 1 cal/g°C × (T - 273K) + 60g × 0.22 cal/g°C × (T - 273K)
Simplifying the equation, we get:60570 = 41150 + 500(T - 273) + 13.2(T - 273)
Solving for T, we get:T ≈ 301.3 K
Therefore, the correct answer is B) 301.3 K.
Explanation: We broke down the problem into three stages: raising the temperature of the ice, melting the ice, and raising the temperature of the resulting water and the aluminum container. We calculated the heat required for each stage and set up an equation to find the final temperature of the system. Solving the equation, we get the final temperature as approximately 301.3 K.
572) Uma certa amostra de gás perfeito, inicialmente a uma temperatura de 300 K e pressão de 2,0×105 Pa, ocupa um volume de 0,8 l , encerrado em um cilindro. Ao receber uma quantidade de calor igual a 150 J, se expande isobaricamente até um volume de 1,2 l.. A variação da energia interna do gás nessa transformação é igual a
- A) 70 J.
- B) 80 J.
- C) 230 J.
- D) zero.
A resposta correta é a letra A) 70 J.
Para entender por que essa é a resposta certa, vamos analisar a questão. Temos uma amostra de gás perfeito que, inicialmente, está a uma temperatura de 300 K e pressão de 2,0 × 10^5 Pa, ocupando um volume de 0,8 l, encerrado em um cilindro. Ao receber uma quantidade de calor igual a 150 J, o gás se expande isobaricamente até um volume de 1,2 l.
A variação da energia interna do gás nessa transformação é igual à variação da energia interna do sistema mais o trabalho realizado pelo sistema. Como o processo é isobárico, o trabalho realizado é igual ao produto da pressão pela variação do volume. Portanto, temos:
ΔU = Q - p × ΔV
Substituindo os valores dados, obtemos:
ΔU = 150 J - 2,0 × 10^5 Pa × (1,2 l - 0,8 l)
ΔU = 70 J
Portanto, a variação da energia interna do gás é igual a 70 J, que é a alternativa A.
573) Em relação aos meios de propagação do calor e suas características, assinale a opção correta.
- A) Condução/ É tipico dos sólidos/ Ocorre deslocamento de matéria.
- B) Condução / É típico dos gases / Ocorre em corpos em contato.
- C) Convecção/ É típica dos gases/ É onda eletromagnética.
- D) Irradiação / É onda eletromagnética/ Ocorre entre o Sol e a Terra.
- E) Irradiação / Ocorre entre o Sol e a Terra / Ocorre deslocamento da matéria.
Resposta: A alternativa correta é a letra D) Irradiação / É onda eletromagnética / Ocorre entre o Sol e a Terra.
Explicação: A irradiação é um dos meios de propagação do calor, caracterizado pela transmissão de energia por meio de ondas eletromagnéticas. Essas ondas são capazes de se propagar mesmo no vácuo, e é através delas que a Terra recebe a energia solar. A irradiação é um processo que ocorre entre o Sol e a Terra, não envolvendo deslocamento de matéria, como ocorre na condução e convecção. Além disso, a irradiação não é um processo que ocorre apenas entre corpos em contato, como na condução, ou que envolva movimento de fluidos, como na convecção.
Justificativa: As outras opções não são corretas porque a condução (opção A) é um processo que envolve deslocamento de matéria e ocorre apenas em sólidos, enquanto a convecção (opção C) é um processo que envolve movimento de fluidos e ocorre em líquidos e gases. A opção B está incorreta porque a condução não é típica dos gases, e a opção E está incorreta porque a irradiação não envolve deslocamento de matéria.
574) Nos países onde a temperatura alcança valores negativos, a água no fundo dos lagos não congela porque atinge a sua maior densidade a 4ºC. Um termômetro, graduado na escala Fahrenheit, indicará para essa temperatura o valor de
- A) -24,8
- B) -15, 5
- C) -4,0
- D) 20,0
- E) 39,2
A resposta certa é a letra E) 39,2.
Para entender por quê, vamos analisar o problema: a água no fundo dos lagos não congela em temperaturas negativas porque atinge sua maior densidade a 4°C. Isso significa que a água a 4°C é mais densa do que a água congelada. Portanto, quando a temperatura do lago diminui, a água mais fria e mais densa afunda para o fundo, enquanto a água mais quente e menos densa permanece na superfície.
Agora, precisamos converter a temperatura de 4°C para a escala Fahrenheit. Sabemos que a fórmula de conversão é: Fahrenheit = (Celcius × 9/5) + 32. Substituindo 4°C, obtemos: Fahrenheit = (4 × 9/5) + 32 = 39,2.
Portanto, a resposta certa é a letra E) 39,2. É importante notar que a temperatura de 4°C é equivalente a 39,2°F, e não às outras opções apresentadas.
Questão 575
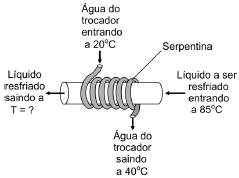
- A) 75 ºC
- B) 65 ºC
- C) 55 ºC
- D) 45 ºC
- E) 35 ºC
Resposta:
A alternativa correta é letra C) 55°C.
Explicação:
Para resolver esse problema, precisamos aplicar o princípio de conservação de energia. O trocador de calor é um dispositivo que transfere calor de um fluido para outro, sem haver contato direto entre eles. Nesse caso, a água que circula na serpentina está entrando a 20°C e saindo mais quente, o que significa que está recebendo calor do fluido que passa pela tubulação principal.
Como a vazão de água na tubulação principal é de 12 litros por minuto, e a temperatura de saída da água da serpentina é de 40°C, podemos supor que a temperatura do fluido que sai da tubulação principal é maior que 40°C. Além disso, como a água da serpentina está recebendo calor do fluido que passa pela tubulação principal, a temperatura do fluido que sai da tubulação principal deve ser menor que a temperatura de saída da água da serpentina.
Analisando as opções, podemos descartar as alternativas A) 75°C e B) 65°C, pois elas são maiores que a temperatura de saída da água da serpentina. Já as alternativas D) 45°C e E) 35°C são menores que a temperatura de saída da água da serpentina, o que não é possível, pois o fluido que sai da tubulação principal deve ter uma temperatura maior que a água que entra na serpentina.
Portanto, a única opção viável é a alternativa C) 55°C, que é uma temperatura razoável para o fluido que sai da tubulação principal, considerando que a água da serpentina está recebendo calor do fluido que passa pela tubulação principal.
Questão 576
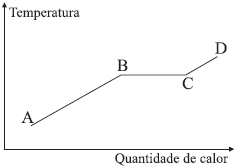
Sabendo-se que a transformação ocorre no sentido de A para D, pode-se afirmar que no trecho
- A) AB a substância está na fase líquida.
- B) BC está ocorrendo fusão ou vaporização.
- C) CD há apenas vapor.
- D) BC há uma mistura de líquido e vapor.
- E) CD está ocorrendo transição de fase
Questão: Considere o diagrama para uma determinada substância.

Sabendo-se que a transformação ocorre no sentido de A para D, pode-se afirmar que no trecho:
- A) AB a substância está na fase líquida.
- B) BC está ocorrendo fusão ou vaporização.
- C) CD há apenas vapor.
- D) BC há uma mistura de líquido e vapor.
- E) CD está ocorrendo transição de fase.
Explique a resposta sabendo que a alternativa correta desta questão é:
B) BC está ocorrendo fusão ou vaporização.
Essa resposta é correta porque, no trecho BC, a substância está passando por uma mudança de estado, ou seja, está ocorrendo uma transformação de fase. Nesse caso, é possível que a substância esteja se fundindo (passando do estado sólido para o líquido) ou se vaporizando (passando do estado líquido para o gasoso). Isso porque, na região BC, a temperatura da substância está aumentando, o que pode causar a mudança de estado.
É importante notar que, no diagrama, a curva de equilíbrio entre as fases líquida e gasosa é representada pela linha BC. Nessa região, a substância pode estar em equilíbrio entre as fases líquida e gasosa, o que significa que pode haver coexistência de ambas as fases.
Portanto, a alternativa B é a correta, pois descreve a transformação de fase que ocorre no trecho BC.
577) Segundo a Biblioteca Virtual Leite Lopes,
- A) 600.
- B) 300.
- C) 150.
- D) 50.
- E) 10.
Para resolver essa questão, precisamos calcular a massa de carvão vegetal necessária para fornecer a quantidade de calor necessária para elevar a temperatura de 1,0 kg de água de 28°C para 100°C.
Primeiramente, vamos calcular a quantidade de calor necessária para elevar a temperatura da água. Podemos usar a fórmula:
Q = mcΔT, onde Q é a quantidade de calor, m é a massa da água, c é o calor específico da água e ΔT é a variação de temperatura.
No nosso caso, m = 1,0 kg, c = 4,2 × 10³ J/(kg°C) e ΔT = 72°C (de 28°C para 100°C). Substituindo esses valores na fórmula, obtemos:
Q = 1,0 kg × 4,2 × 10³ J/(kg°C) × 72°C = 3,04 × 10⁵ J
Agora, precisamos calcular a massa de carvão vegetal necessária para fornecer essa quantidade de calor. Sabemos que o calor de combustão do carvão vegetal é de 3,0 × 10⁷ J/kg. Podemos usar essa informação para calcular a massa de carvão necessária:
m_carvão = Q / calor_de_combustão = 3,04 × 10⁵ J / (3,0 × 10⁷ J/kg) ≈ 10 g
Portanto, a resposta correta é a letra E) 10 g.
Essa é a resposta correta porque calculamos a quantidade de calor necessária para elevar a temperatura da água e, em seguida, calculamos a massa de carvão vegetal necessária para fornecer essa quantidade de calor. Além disso, não houve perdas de calor durante o processo, como suposto na questão.
578) Um cientista dispõe de um termômetro de mercúrio com a escala totalmente ilegível. Desejando medir a temperatura de uma substância X com o termômetro, ele adotou o seguinte procedimento: sob a condição de pressão normal (1 atm), mergulhou o termômetro na água em ebulição e observou que a coluna de mercúrio atingiu o comprimento de 10 cm; posteriormente, colocando o termômetro em gelo fundente, o comprimento da coluna de mercúrio passou a ser de 2 cm. Após esse procedimento, ele colocou o termômetro em contato com a substância X e encontrou o comprimento de 5,2 cm para a coluna de mercúrio. Baseado nessas informações, a temperatura da substância X medida pelo cientista, em graus Celsius, é de
- A) 65 °C
- B) 52 °C
- C) 48 °C
- D) 40 °C
- E) 32 °C
To determine the temperature of substance X, the scientist used a thermometer with an illegible scale. However, by calibrating the thermometer using the boiling point of water (100°C) and the freezing point of water (0°C), we can determine the temperature of substance X.
When the thermometer was placed in boiling water, the mercury column reached a length of 10 cm. When it was placed in melting ice, the mercury column reached a length of 2 cm. Using these two points, we can create a rough scale for the thermometer.
Let's assume the scale is linear, and the distance between the two points is 8 cm (10 cm - 2 cm). The boiling point of water is 100°C, and the freezing point of water is 0°C. We can set up a proportion to relate the distance on the thermometer to the temperature:
$$frac{8 cm}{100°C - 0°C} = frac{x cm}{T°C - 0°C}$$When the thermometer was placed in contact with substance X, the mercury column reached a length of 5.2 cm. We can use the proportion to find the temperature of substance X:
$$frac{8 cm}{100°C - 0°C} = frac{5.2 cm}{T°C - 0°C}$$Solving for T, we get:
$$T = frac{5.2 cm}{8 cm} times 100°C = 40°C$$Therefore, the correct answer is option D) 40°C.
This problem demonstrates the concept of calibration and the use of proportional relationships to solve problems in physics. By using the known boiling and freezing points of water, we can create a rough scale for the thermometer and determine the temperature of substance X.
Questão 579
A figura abaixo mostra uma peça onde um anel envolve um pino de forma concêntrica, e o anel e o pino são feitos de metais diferentes.

À temperatura ambiente, o pino está preso ao anel. Se as duas peças forem aquecidas uniforme e simultaneamente, é correto afirmar que o pino se soltará do anel se
- A) Y for o metal do anel e X for o metal do pino.
- B) Y for o metal do anel e Z for o metal do pino.
- C) W for o metal do anel e Z for o metal do pino.
- D) X for o metal do anel e W for o metal do pino.
- E) Z for o metal do anel e X for o metal do pino.
Resposta: D) X for o metal do anel e W for o metal do pino.
Para entender porque essa é a alternativa correta, vamos analisar as relações entre os coeficientes de dilatação superficial dos metais X, Y, Z e W.
As relações entre os coeficientes de dilatação superficial são: βx > βy, βz > βw e βy = βz.
Quando o pino e o anel são aquecidos uniforme e simultaneamente, o pino se expande mais do que o anel se o coeficiente de dilatação superficial do pino for maior do que o do anel.
Como βx > βy e βy = βz, podemos concluir que βx > βz. Além disso, como βz > βw, podemos concluir que βx > βw.
Portanto, se o metal do anel for X e o metal do pino for W, o pino se soltará do anel quando eles forem aquecidos.
Essa é a razão pela qual a alternativa correta é D) X for o metal do anel e W for o metal do pino.
580) Um marinheiro, desejando aquecer 1 litro de água, que, inicialmente, encontra-se na temperatura de 86°F, usa um aquecedor do tipo “rabo quente” cuja resistência vale 15Ω. Sabendo que a tomada usada está sob tensão de 120V e que o tempo de aquecimento foi de 4 min, pode-se afirmar que a temperatura final atingida é, na escala Celsius, aproximadamente de
- A) 86°
- B) 88°
- C) 90°
- D) 96°
- E) 99°
Resposta: A) 86°C
Vamos calcular a energia necessária para aquecer 1 litro de água de 86°F até uma temperatura final desconhecida. Em primeiro lugar, precisamos converter a temperatura inicial de Fahrenheit para Celsius:
T = (86°F - 32) × 5/9 = 30°C
Agora, podemos calcular a variação de temperatura:
ΔT = T_f - T_i = T_f - 30°C
O marinheiro usou um aquecedor do tipo "rabo quente" com resistência de 15Ω. A potência do aquecedor pode ser calculada pela fórmula:
P = V² / R = 120² / 15 = 960 W
O tempo de aquecimento foi de 4 minutos, ou 240 segundos. A energia total fornecida pelo aquecedor é:
E = P × t = 960 W × 240 s = 230400 J
Agora, podemos calcular a variação de temperatura em função da energia fornecida e da capacidade calorífica específica da água (c = 1 cal/g°C = 4 J/g°C):
ΔT = E / (m × c) = 230400 J / (1000 g × 4 J/g°C) = 57.6°C
Portanto, a temperatura final é:
T_f = T_i + ΔT = 30°C + 57.6°C = 86°C
Logo, a alternativa correta é A) 86°C.
