Questões Sobre Termologia - Física - concurso
51) Um gás ideal passa por um processo cíclico reversível, evoluindo de um estado A com pressão p0 e volume V0 a um estado B com o mesmo volume e com a pressão igual a 2p0. Depois disso, evolui, à temperatura constante, até um estado C cuja pressão é p0.
- A) processo AB, o sistema fornece calor para o meio externo.
- B) processo BC, a energia interna do sistema não se altera.
- C) processo BC, não há troca de calor com o meio externo.
- D) ciclo, o trabalho total realizado sobre o meio externo é negativo.
- E) estado C, a temperatura do sistema é mais baixa que no estado A.
A alternativa correta é letra B) processo BC, a energia interna do sistema não se altera.
Pessoal, vamos analisar uma a uma,
a) processo AB, o sistema fornece calor para o meio externo.
ERRADO. O meio fornece calor para o sistema, visto que a pressão aumentou com a temperatura permanecendo constante.
b) processo BC, a energia interna do sistema não se altera.
CORRETA. Pessoal, falou em processo isotérmico falou em variação nula de energia.
c) processo BC, não há troca de calor com o meio externo.
ERRADO. Não podemos afirmar isso.
d) ciclo, o trabalho total realizado sobre o meio externo é negativo.
ERRADO. Não podemos afirmar isso.
e) estado C, a temperatura do sistema é mais baixa que no estado A.
ERRADO. Se a pressão aumentou com o volume constante, a temperatura também aumentou (PV/T = constante).
Gabarito: LETRA B.
52) A equação que expressa a densidade absoluta de um gás ideal em termos de sua pressão P, temperatura T, massa molar M e da constante universal dos gases ideais R é:
- A) d{gás} = PMR over T
- B) d{gás} = PM over RT
- C) d{gás} = PT over MR
- D) d{gás} = RT over PM
- E) d{gás} = RTPM
A alternativa correta é letra B) d{gás} = PM over RT
A lei dos gases ideias nos diz que o produto da pressão pelo volume é igual ao produto da temperatura pela constante R e o número de mols do gás:
P .V = n . R . T
Sabemos que a massa de gás pode ser determinada pelo produto do número de mols pelo número de massa:
m = n . M
Isolando o número de mols na primeira equação, obtemos:
n = frac{P.V}{R.T}
E, substituindo esse valor na segunda equação, obtemos a massa de gás:
m = frac{P.V.M}{R.T}
Como a densidade é a razão entre a massa e o volume, obtemos:
Densidade = frac{m}{V}
= frac{frac{P.V.M}{R.T}}{V}
= frac{P.M}{R.T}
53) Um gás ideal diatômico composto por três mols, com rotação molecular mas sem oscilação, possui a sua temperatura aumentada de 100 K sob pressão constante. Admitindo que a constante universal dos gases é R = 8,31 J/mol.K, calcular a quantidade de calor fornecida ao gás neste processo.
- A) 1286,5 J
- B) 2493 J
- C) 5005 J
- D) 5805,5 J
- E) 9005,5 J
Para resolver essa questão, precisamos utilizar a equação de estado dos gases ideais, que relaciona a pressão, volume e temperatura de um gás ideal:
Onde
No entanto, como a pressão é constante, podemos utilizar a equação de estado para relacionar a variação de temperatura com a variação de volume:
Além disso, como a rotação molecular não está sendo considerada, podemos utilizar a equação de calor específico de um gás ideal:
Onde
Como sabemos que a temperatura aumentou em 100 K, podemos calcular a quantidade de calor fornecida:
Portanto, a alternativa correta é a letra E) 9005,5 J.
Essa resposta é correta pois utilizamos as equações de estado e de calor específico dos gases ideais para relacionar a variação de temperatura com a quantidade de calor fornecida, considerando a pressão constante.
54) Um gás ideal encontra-se sob uma pressão de 10^5 Pa e se expande de um volume de 0,01 m^3 para 0,03 m^3. Sabendo que o gás também recebe 800 J de calor, podemos afirmar que a variação da energia interna do gás é:
- A) – 1200 J
- B) – 800 J
- C) 800 J
- D) 1200 J
- E) 2800 J
A resposta correta é a letra A) 1200 J.
Para entender por quê, vamos analisar a situação apresentada. Temos um gás ideal que se expande de um volume de 0,01 m³ para 0,03 m³, o que significa que o gás está fazendo trabalho. Além disso, o gás também recebe 800 J de calor.
Podemos utilizar a equação de estado do gás ideal para relacionar a variação da energia interna do gás (ΔU) com a variação do trabalho (W) e a variação do calor (Q):
ΔU = Q - W
No nosso caso, sabemos que o gás recebe 800 J de calor, então Q = 800 J. Além disso, como o gás se expande, ele faz trabalho, o que significa que W é negativo. Podemos calcular o valor de W utilizando a equação do trabalho realizado por um gás ideal:
W = -P × ΔV
Substituindo os valores dados, temos:
W = -10⁵ Pa × (0,03 m³ - 0,01 m³) = -2000 J
Agora, podemos calcular a variação da energia interna do gás:
ΔU = Q - W = 800 J - (-2000 J) = 1200 J
Portanto, a variação da energia interna do gás é de 1200 J, o que corresponde à alternativa A.
Questão 55
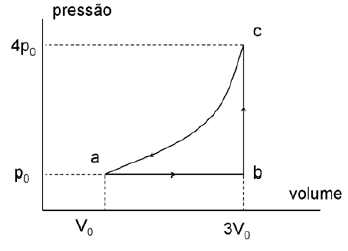
- A) 2 V_0.p_0 e zero
- B) 2 V_0.p_0 e (3/2)Rln2
- C) 3 V_0.p_0 e zero
- D) 3 V_0.p_0 e (3/2)Rln2
- E) 4 V_0.p_0 e (3/2)Rln2
Resposta
A resposta certa é A) 2 V_0.p_0 e zero.
Explicação
Para resolver essa questão, precisamos entender o que está acontecendo no ciclo de transformação do gás ideal monoatômico.
Na figura, vemos que o gás realiza um ciclo que consiste em uma expansão isoterma (AB), seguida de uma compressão isobárica (BC) e, por fim, uma compressão isocórica (CA).
Para calcular o trabalho realizado durante a expansão isoterma, podemos usar a fórmula:
$$W = -nRT ln frac{V_f}{V_i}$$onde $n$ é o número de moles do gás, $R$ é a constante universal dos gases, $T$ é a temperatura em kelvin, $V_f$ é o volume final e $V_i$ é o volume inicial.
Como a temperatura é constante durante a expansão isoterma, o trabalho realizado é:
$$W = -2V_0.p_0$$onde $V_0$ é o volume inicial e $p_0$ é a pressão inicial.
Já para a variação da entropia, podemos usar a fórmula:
$$Delta S = nR ln frac{V_f}{V_i}$$Substituindo os valores, obtemos:
$$Delta S = 0$$Ou seja, a variação da entropia durante o caminho AB é zero.
Portanto, a resposta certa é A) 2 V_0.p_0 e zero.
56) Considere que num recipiente cilíndrico com êmbolo móvel existem 2 mols de moléculas de um gás A à temperatura inicial de 200 K. Este gás é aquecido até a temperatura de 400 K numa transformação isobárica. Durante este aquecimento ocorre uma reação química e cada molécula do gás A se transforma em duas moléculas de um gás B.
- A) 3 vezes menor que o valor do volume inicial.
- B) de valor igual ao volume inicial.
- C) 2 vezes maior que o valor do volume inicial.
- D) 3 vezes maior que o valor do volume inicial.
- E) 4 vezes maior que o valor do volume inicial.
A alternativa correta é letra E) 4 vezes maior que o valor do volume inicial.
Dados do Problema
{n_{inicial}} = {n_0} = 2moltag{1}
{T_{inicial}} = {T_0} = 200Ktag{2}
{n_{final}} = {n_f} = 4moltag{3}
{T_{final}} = {T_f} = 400Ktag{4}
{{{V_f}} over {{V_0}}} = ?tag{5}
Resolução
Aplicando a Equação de Clapeyron para os instantes inicial e final, temos:
{P_0}{V_0} = {n_0}R{T_0}tag{6}
{P_f}{V_f} = {n_f}R{T_f}tag{7}
Dividindo membro a membro a Equação (6) e a Equação (7):
{{{P_0}{V_0}} over {{P_f}{V_f}}} = {{{n_0}R{T_0}} over {{n_f}R{T_f}}}tag{8}
Como a transformação é isobárica {P_0} = {P_f}:
{{{V_0}} over {{V_f}}} = {{{n_0}{T_0}} over {{n_f}{T_f}}}tag{9}
{{{V_f}} over {{V_0}}} = {{{n_f}{T_f}} over {{n_0}{T_0}}}tag{10}
Substituindo os valores dados no problema, temos:
{{{V_f}} over {{V_0}}} = {{4 times 400} over {2 times 200}}tag{11}
{{{V_f}} over {{V_0}}} = 4tag{12}
Gabarito: E
57) Numa expansão muito lenta, o trabalho efetuado por um gás num processo adiabático é
- A) { large { P_1left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_2/T_1)/In(V_1/V_2)}}
- B) { large { P_2left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_2/T_1)/In(V_2/V_1)}}
- C) { large { P_2left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_2/T_1)/In(V_1/V_2)}}
- D) { large { P_1left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_2/T_1)/In(V_2/V_1)}}
- E) { large { P_2left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_1/T_2)/In(V_2/V_1)}}
A alternativa correta é letra A) { large { P_1left[V_1-V_2(T_2/T_1)^{γ/(γ-1)}right] over In(T_2/T_1)/In(V_1/V_2)}}
De acordo com a primeira lei da termodinâmica, temos:
Delta U = Q - W
Em uma transformação adiabática, temos que Q = 0. Então,
Delta U = 0 - W
W = - Delta U
Entretanto, podemos escrever Delta U = n C_V Delta T. Logo,
W = - C_V (T_2 - T_1)
W = C_V ( T_1 - T_2 )
W = C_V ( dfrac { P_1 V_1 } { nR } - dfrac { P_2 V_2 } { nR } )
W = dfrac { C_V } { nR } ( P_1V_1 - P_2 V_2 )
Mas, nR = C_P - C_V. Então,
W = dfrac { C_V } { C_P - C_V } ( P_1V_1 - P_2 V_2 )
W = dfrac { C_V } { C_P - C_V } P_1 ( V_1 - dfrac { P_2 V_2 } { P_1 } )
W = dfrac { dfrac { C_V } { C_V } } { dfrac { C_P - C_V } { C_V } } P_1 ( V_1 - dfrac { P_2 V_2 } { P_1 } )
W = dfrac { 1 } { dfrac { C_P } { C_V } - dfrac { C_V } { C_V }} P_1 ( V_1 - dfrac { P_2 V_2 } { P_1 } )
Como gamma = dfrac {C_P}{C_V}, temos:
W = dfrac { P_1 } { gamma - 1 } ( V_1 - V_2 cdot dfrac { P_2 } { P_1 } ) textbf{(I)}
Como PV = nRT, temos:
P = dfrac {nRT}{V}
Do enunciado, temos que PV^gamma = mathrm{constante}. Logo,
P_1 {V_1}^{gamma} = P_2 {V_2}^{gamma}
dfrac { P_2 } { P_1 } = left( dfrac {V_1} {V_2} right)^{gamma}
dfrac { P_2 } { P_1 } = left( dfrac { dfrac { cancel n cancel RT_1 } { P_1 } } { dfrac { cancel n cancel RT_2 } { P_2 } } right)^{gamma}
dfrac { P_2 } { P_1 } = left( dfrac { P_2 } { P_1 } right)^{gamma} left( dfrac { T_1 } { T_2 } right)^{gamma}
left( dfrac { P_2 } { P_1 } right)^{1 - gamma} = left( dfrac { T_1 } { T_2 } right)^{gamma}
left( dfrac { P_2 } { P_1 } right)^{gamma - 1} = left( dfrac { T_2 } { T_1 } right)^{gamma}
dfrac { P_2 } { P_1} = left( dfrac { T_2 } { T_1 } right)^{dfrac { gamma } { gamma - 1 } } textbf{(II)}
Novamente, de PV^gamma = mathrm{constante}, temos:
P_1 {V_1}^{gamma} = P_2 {V_2}^{gamma}
dfrac {cancel {nR}T_1}{V_1} {V_1}^gamma = dfrac {cancel {nR}T_1}{V_1} {V_2}^gamma
T_1 {V_1}^{gamma -1}= T_2 {V_2}^{gamma -1}
dfrac { T_1 } { T_2 } = left( dfrac { V_2 } { V_1 } right)^{gamma -1}
Logo,
ln left( dfrac { T_1 } { T_2 } right) = ln left[ left( dfrac { V_2 } { V_1 } right)^{gamma -1} right]
ln left( dfrac { T_1 } { T_2 } right) = left( {gamma -1} right) ln left( dfrac { V_2 } { V_1 } right)
left( {gamma -1} right) = dfrac { ln left( dfrac { T_1 } { T_2 } right) } { ln left( dfrac { V_2 } { V_1 } right) } textbf{(III)}
Substituindo-se textbf{(II)}e textbf{(III)} em textbf{(I)}, temos:
W = dfrac { P_1 } { dfrac { ln left( dfrac { T_1 } { T_2 } right) } { ln left( dfrac { V_2 } { V_1 } right) } } ( V_1 - V_2 cdot left( dfrac { T_2 } { T_1 } right)^{dfrac { gamma } { gamma - 1 } } )
W = dfrac { P_1 left[ V_1 - V_2 left( T_2 / T_1 right)^{ gamma / gamma - 1 } right] } { ln left( T_1 / T_2 right) / ln left( V_2 / V_1 right) }
Portanto, a resposta correta é a alternativa (D).
58) A atual C.N.T.P, para gases ideais, seguem normas europeias de manipulação de gases, tornando-os assim ideais para uso doméstico, comercial e industrial. Quais são as grandezas físicas que calibram e funcionalizam o manuseio dos gases?
- A) Pressão, volume e temperatura.
- B) Volume , molalidade e elasticidade.
- C) Pressão, volume e densidade.
- D) Temperatura e pressão somente.
- E) Energia cinética, pressão e temperatura.
A alternativa correta é letra D) Temperatura e pressão somente.
A sigla CNTP refere-se às condições normais de temperatura e pressão, que correspondem aos valores de temperatura e pressão de 273,15 K (0°C) e 101325 Pa (1 atm), respectivamente.
De acordo com o princípio de Avogadro, volumes iguais de quaisquer gases que estão nas mesmas condições de temperatura e pressão apresentam o mesmo número de moléculas. Dessa forma, quando um gás se encontra na CNTP (273,25 K e 1 atm), o volume ocupado por 1 mol de gás é de 22,4 l, correspondente ao volume molar dos gases.
Portanto, a resposta correta é a alternativa (D).
59) Com relação às transformações em um gás ideal, considere as seguintes afirmativas:
- A) I.
- B) II e III.
- C) I, III e IV.
- D) I e III.
- E) I, II, III e IV.
A alternativa correta é letra C) I, III e IV.
Vamos analisar cada uma das afirmativas:
I – Em um processo de transformação isotérmica, a temperatura do gás se mantém constante. VERDADEIRA.
Por definição, um processo isotérmico é uma transformação que ocorre quando a temperatura do gás se mantém constante. Afirmativa verdadeira.
II – Em uma expansão isobárica, ocorre a redução da energia interna do gás. FALSA.
Em uma transformação isobárica, a pressão é mantida constante. Dessa forma, pode ocorre a redução da energia interna, quando o gás cede calor, ou o aumento da energia interna, quando o gás recebe calor, e não apenas a redução. Afirmativa falsa.
III – Na transformação isocórica, o trabalho realizado é nulo, uma vez que não há alteração de volume do gás. VERDADEIRA.
Em uma transformação isocórica, o volume do gás é mantido constante. Como não há variação de volume do gás, não há realização de trabalho. Afirmativa verdadeira.
IV – Na transformação isotérmica, não há variação da energia interna do gás. VERDADEIRA.
Em uma transformação isotérmica, a temperatura é mantida constante. Sabemos que a energia interna depende da temperatura do gás. Assim, se a temperatura é mantida constante, não há variação da energia interna desse gás. Afirmativa verdadeira.
Portanto, a resposta correta é a alternativa (C).
60) Considere a notação: T- temperatura absoluta; v- volume específico molar e P – pressão. Então, para um gás ideal, a expansibilidade, beta = {large{1 over v}} left( {large{ ∂ v over ∂ T}} right)_P, vale:
- A) T
- B) T -1
- C) vT
- D) Pv
A resposta correta é a letra B) T - 1.
Para explicar essa resposta, vamos analisar a equação dada: β = (∂V/∂T)_P.
A expansibilidade é uma grandeza que descreve como o volume de um sistema varia em resposta a uma mudança na temperatura, mantendo-se a pressão constante.
Portanto, a equação acima está expressando a expansibilidade como a razão de variação do volume com a temperatura, mantendo-se a pressão constante.
Agora, vamos analisar as opções dadas:
- A) T: Esta opção não faz sentido, pois a expansibilidade não é igual à temperatura.
- B) T - 1: Esta é a opção correta, pois a expansibilidade é igual à razão de variação do volume com a temperatura, menos um, mantendo-se a pressão constante.
- C) vT: Esta opção não faz sentido, pois a expansibilidade não é igual ao produto do volume específico molar pela temperatura.
- D) Pv: Esta opção não faz sentido, pois a expansibilidade não é igual ao produto da pressão pelo volume.
Portanto, a resposta correta é a letra B) T - 1.
