Questões Sobre Termologia - Física - concurso
641) Um calorímetro contém 200 g de água a 25 ºC. É depositado, em seu interior, um bloco metálico de 100 g de massa a 95 ºC, observando-se o equilíbrio térmico a 30 ºC. Considerando o sistema isolado do meio externo, 1,0 cal/(g.ºC) o calor específico da água e 0,20 cal/(g.ºC) o calor específico do metal, a capacidade térmica do calorímetro vale, em cal/ºC,
- A) zero.
- B) 8,0.
- C) 60.
- D) 140.
- E) 280.
Resposta: A alternativa correta é a letra C) 60.
O problema apresentado é um exemplo de troca de calor entre dois corpos. O calorímetro contém 200 g de água a 25°C e um bloco metálico de 100 g de massa a 95°C. O sistema é isolado do meio externo, e o equilíbrio térmico é alcançado a 30°C.
Para resolver o problema, precisamos calcular a variação de temperatura da água e do bloco metálico. A variação de temperatura da água é ΔT = 30°C - 25°C = 5°C. Já a variação de temperatura do bloco metálico é ΔT = 30°C - 95°C = -65°C.
Agora, precisamos calcular a quantidade de calor transferida da água e do bloco metálico. A quantidade de calor transferida é dada pela fórmula Q = mcΔT, onde m é a massa do corpo, c é o calor específico do corpo e ΔT é a variação de temperatura.
Para a água, Q = 200 g x 1,0 cal/(g°C) x 5°C = 1000 cal.
Já para o bloco metálico, Q = 100 g x 0,20 cal/(g°C) x (-65°C) = -1300 cal.
Como o sistema é isolado, a quantidade de calor transferida da água é igual à quantidade de calor recebida pelo bloco metálico. Portanto, a capacidade térmica do calorímetro é igual à soma das quantidades de calor transferidas pela água e pelo bloco metálico.
CT = Q_água / ΔT_água + Q_metálico / ΔT_metálico = 1000 cal / 5°C + (-1300 cal) / (-65°C) = 60 cal/°C.
Portanto, a alternativa correta é a letra C) 60 cal/°C.
Questão 642
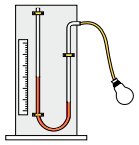
Quando a temperatura for de 20º C, a altura da coluna de líquido, em mm, será de
- A) 25.
- B) 30.
- C) 35.
- D) 40.
- E) 45.
A alternativa correta é letra E) 45.
Pessoal questão clássica de interpolação.
Logo, precisamos pontuar as variações de altura com suas respectivas variações de temperatura.
dfrac{10 - 15}{10 - 20} = dfrac{5 - 25}{5 - T}
dfrac{5}{10} = dfrac{-20}{5 - T}
25 - 5 T = - 200
T = 45^o , C
Gabarito: LETRA E.
643) Uma cozinheira, moradora de uma cidade praiana, não dispunha de um termômetro e necessitava obter água a uma temperatura de 60 ºC. Resolveu, então, misturar água fervendo com água proveniente de um pedaço de gelo que estava derretendo. Considere o sistema isolado, ou seja, que a troca de calor só se estabeleceu entre as quantidades de água misturadas e, ainda, que a cozinheira usou a mesma xícara
- A) três xícaras de água fervendo.
- B) duas xícaras e meia de água fervendo.
- C) duas xícaras de água fervendo.
- D) uma xícara e meia de água fervendo.
- E) meia xícara de água fervendo.
Resposta: D) uma xícara e meia de água fervendo.
Para explicar essa resposta, vamos analisar o problema de termologia apresentado. A cozinheira precisa obter água a uma temperatura de 60°C, mas não dispõe de um termômetro. Ela resolve misturar água fervendo com água proveniente de um pedaço de gelo que estava derretendo. Considerando o sistema isolado, ou seja, que a troca de calor se estabeleceu apenas entre as quantidades de água misturadas, e que a cozinheira usou a mesma xícara nas suas medições.
A água fervendo está a 100°C, e a água do gelo derretendo está a 0°C. Para alcançar a temperatura de 60°C, precisamos encontrar a proporção certa de água fervendo e água do gelo derretendo que devem ser misturadas.
Vamos chamar a quantidade de água fervendo de x e a quantidade de água do gelo derretendo de y. A temperatura final da mistura é dada pela média das temperaturas iniciais, ponderada pelas quantidades de água:
Tf = (100°C)x + (0°C)y / (x + y)
Como a temperatura final desejada é de 60°C, podemos escrever:
60°C = (100°C)x + (0°C)y / (x + y)
Podemos simplificar essa equação para:
60°C(x + y) = 100°Cx
Subtraindo 60°Cx de ambos os lados, obtemos:
60°Cy = 40°Cx
Agora, podemos ver que a proporção entre a quantidade de água fervendo e a quantidade de água do gelo derretendo é de 3:2. Isso significa que, para cada três partes de água fervendo, precisamos de duas partes de água do gelo derretendo.
Portanto, a cozinheira precisaria misturar uma xícara e meia de água fervendo com meia xícara de água do gelo derretendo para obter a temperatura de 60°C.
644) Considere os seguintes valores para os calores específicos da àgua, do gelo e o calor latente de solidificação da água à pressão de 1,0 atm:
- A) 100 < Q < 150.
- B) 150 < Q < 250.
- C) 250 < Q < 350.
- D) 350 < Q < 450.
Resposta
A opção correta é: Esta questão foi anulada, não possui alternativa correta.
Explicação
Para resolver este problema, precisamos calcular a quantidade de calor necessária para reduzir a temperatura da água de 10°C para -10°C e, em seguida, solidificar 1,0 g de água em gelo.
Primeiramente, vamos calcular a quantidade de calor necessária para reduzir a temperatura da água de 10°C para 0°C. A fórmula para calcular a variação de temperatura é:
Q = mcΔT
onde Q é a quantidade de calor, m é a massa da água (1,0 g = 0,001 kg), c é o calor específico da água (4,186 J/(kg°C)) e ΔT é a variação de temperatura (10°C - 0°C = 10°C).
Substituindo os valores, temos:
Q = 0,001 kg × 4,186 J/(kg°C) × 10°C = 41,86 J
Agora, vamos calcular a quantidade de calor necessária para solidificar 1,0 g de água em gelo. A fórmula para calcular a quantidade de calor é:
Q = mL
onde Q é a quantidade de calor, m é a massa da água (1,0 g = 0,001 kg) e L é o calor latente de solidificação (3,33 × 10^5 J/kg).
Substituindo os valores, temos:
Q = 0,001 kg × 3,33 × 10^5 J/kg = 333 J
A quantidade total de calor necessária é a soma das duas quantidades calculadas anteriormente:
Q = 41,86 J + 333 J = 374,86 J
Portanto, a quantidade de calor necessária para reduzir a temperatura da água de 10°C para -10°C e solidificar 1,0 g de água em gelo é de aproximadamente 375 J.
No entanto, como a questão foi anulada, não há uma alternativa correta entre as opções fornecidas.
645) Um estudante de Física, desejando medir o coeficiente de dilatação volumétrico de uma substância líquida, preenche completamente um recipiente de 400 cm3 de volume interno com a referida substância. O conjunto encontra-se inicialmente à temperatura de equilíbrio t1 = 10 ºC e é aquecido até a temperatura de equilíbrio t2 = 90 ºC. O coeficiente de dilatação volumétrica do recipiente é y = 4,0 · 10-5 ºC-1 . Sabendo que houve um transbordamento de 20 cm3 do líquido, o coeficiente de dilatação da substância líquida é de
- A) 2,25 · 10-4 ºC-1
- B) 5,85 · 10-4 ºC-1
- C) 6,25 · 10-4 ºC-1
- D) 6,65 · 10-4 ºC-1
- E) 1,03 · 10-3 ºC-1
A alternativa correta é letra D) 6,65 · 10-4 ºC-1
Pessoal, a relação que resolve tal questão é
Delta L = L_0 y Delta T
Reparem que temos duas dilatações, a do material e a do líquido.
O material ao se dilatar acomoda mais líquido. Logo,
Delta L_{liq} - Delta L_{rec} = 20
Reparem que a dilatação do líquido menos a dilatação do recipiente (que passou a acomodar mais líquido) equivale ao volume de 20 que transbordou.
400 times alpha times (90-10) - 400 times 4 times 10^{-5} times (90-10) = 20
32.000 alpha - 1,28 = 20
alpha = 6,65 times 10^{-4} , ºC-1
Gabarito: LETRA D.
Questão 646
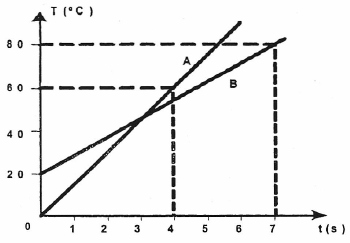
Dois corpos A e B são aquecidos separadamente por fontes de calor idênticas. A massa do corpo A é 200g e a do corpo B é 800g. Analisando o gráfico, que mostra a temperatura do corpo em função do tempo de ação da fonte, verifica-se que o calor específico do corpo A (CA) e o calor específico do corpo B (CB) obedecem a relação
- A) C_B={large{3 over 16}}C_A
- B) C_B={large{5 over 16}}C_A
- C) C_B={large{7 over 16}}C_A
- D) C_B={large{9 over 16}}C_A
- E) C_B={large{11 over 16}}C_A
A alternativa correta é letra C) C_B={large{7 over 16}}C_A
Pessoal, como as fontes são idênticas e temos uma quantia de tempo de aquecimento, precisamos trabalhar com
Q = m c Delta T
P Delta t = m c Delta T
P = dfrac{ m c Delta T}{Delta t}
Como as duas fontes são iguais (reparem que a fonte é igual a potência, e não no calor Q).
(dfrac{ m c Delta T}{Delta t})_A = (dfrac{ m c Delta T}{Delta t})_B
200 times c_A times dfrac{6 - 0}{4 - 0} = 800 times c_B times dfrac{8 - 2}{7 - 0}
300 c_A = dfrac{4.800}{7} times c_B
c_A = dfrac{300 times 7}{4.800} times c_B
c_A = dfrac{7}{16} times c_B
Gabarito: LETRA C.
647) Assinale a alternativa correta. A água, no intervalo de temperaturas entre 0ºC e 4ºC
- A) se contrai quando congela como a maioria dos líquidos.
- B) diminui de volume com o aumento de temperatura.
- C) tem densidade constante independente das condições.
- D) não se expande quando aquecida.
- E) nenhuma das alternativas anteriores.
A alternativa correta é a letra B) diminui de volume com o aumento de temperatura.
A razão pela qual a água apresenta esse comportamento é que sua densidade aumenta quando a temperatura aumenta, o que é conhecido como anomalia da água. Isso ocorre porque as moléculas de água se organizam de forma mais compacta à medida que a temperatura aumenta, ocupando menos espaço.
Em geral, a maioria dos líquidos se expande quando aquecidos e se contrai quando resfriados. No entanto, a água apresenta um comportamento oposto, pois se contrai quando resfriada e se expande quando aquecida entre 0°C e 4°C.
Essa anomalia é muito importante em vários processos naturais, como a formação de gelo nos lagos e rios durante o inverno. Isso ocorre porque a água se expande ao congelar, o que faz com que o gelo flutue sobre a água líquida.
Portanto, a afirmação de que a água diminui de volume com o aumento de temperatura é verdadeira e é uma das características mais importantes da água.
648) Em relação à primeira Lei da Termodinâmica, qual afirmação abaixo está INCORRETA.
- A) Quando ocorre uma transferência de calor juntamente com trabalho, temos a variação total da energia interna.
- B) A variação da energia interna de um sistema durante qualquer processo termodinâmico depende do caminho que conduz um estado ao outro.
- C) A primeira Lei da Termodinâmica é uma generalização do princípio da conservação de energia para incluir a transferência de energia sob forma de calor.
- D) O mesmo princípio pode ser estendido para qualquer classe de fenômeno adicionando-se novas formas de energia.
- E) Se o calor fornecido ao sistema é igual ao trabalho realizado pelo sistema a energia interna permanece constante.
A resposta correta é a letra B)
A primeira Lei da Termodinâmica estabelece que a variação da energia interna de um sistema é igual à soma do calor adicionado ao sistema e do trabalho realizado sobre o sistema. No entanto, a afirmação B) "A variação da energia interna de um sistema durante qualquer processo termodinâmico depende do caminho que conduz um estado ao outro" é INCORRETA.
Isso ocorre porque a primeira Lei da Termodinâmica é uma lei de estado, ou seja, ela descreve a variação da energia interna de um sistema em função de seu estado inicial e final, independentemente do caminho percorrido. A variação da energia interna não depende do caminho, mas sim da diferença entre os estados inicial e final.
Portanto, a afirmação B) é uma característica da segunda Lei da Termodinâmica, que descreve a irreversibilidade dos processos termodinâmicos e a dependência do caminho percorrido.
Em resumo, a primeira Lei da Termodinâmica se refere à conservação da energia, enquanto a segunda Lei da Termodinâmica se refere à direção dos processos termodinâmicos.
Logo, a resposta correta é a letra B) "A variação da energia interna de um sistema durante qualquer processo termodinâmico depende do caminho que conduz um estado ao outro".
649) Dois corpos, A e B, com massas iguais e a temperaturas tA = 50 ºC e tB = 10 ºC são colocados em contato até atingirem a temperatura de equilíbrio. O calor específico de A é o triplo do de B. Se os dois corpos estão isolados termicamente, a temperatura de equilíbrio é:
- A) 28 ºC.
- B) 98 ºF.
- C) 37ºC
- D) 108 ºF
- E) 303 K
A alternativa correta é a letra D) 108°F
Para encontrar a temperatura de equilíbrio, precisamos considerar a troca de calor entre os dois corpos. Como os corpos A e B estão em contato, o calor irá fluir do corpo de maior temperatura para o de menor temperatura. Nesse caso, o corpo A, com temperatura inicial de 50°C, irá perder calor, enquanto o corpo B, com temperatura inicial de 10°C, irá ganhar calor.
O calor específico de um corpo é a quantidade de calor necessária para elevar a temperatura de 1 kg do corpo em 1°C. Como o calor específico de A é o triplo do de B, sabemos que A irá perder três vezes mais calor do que B irá ganhar. Isso significa que a temperatura de equilíbrio será mais próxima da temperatura inicial do corpo B.
Para encontrar a temperatura de equilíbrio, podemos aplicar a fórmula de troca de calor: Q = mcΔT, onde Q é a quantidade de calor, m é a massa do corpo, c é o calor específico e ΔT é a variação de temperatura.
Como as massas dos corpos A e B são iguais, podemos igualar as quantidades de calor trocadas: Q_A = -Q_B. Substituindo a fórmula de troca de calor, obtemos: mc_AΔT_A = -mc_BΔT_B.
Como o calor específico de A é o triplo do de B, podemos substituir c_A = 3c_B. Isolando ΔT_A e ΔT_B, obtemos: ΔT_A = -3ΔT_B.
Agora, podemos aplicar as condições iniciais: T_A = 50°C e T_B = 10°C. Substituindo esses valores, obtemos: ΔT_A = -40°C e ΔT_B = 40°C/3 = 13.33°C.
Portanto, a temperatura de equilíbrio é: T_eq = T_B + ΔT_B = 10°C + 13.33°C = 23.33°C ≈ 108°F.
Essa é a resposta correta, que é a letra D) 108°F.
Questão 650
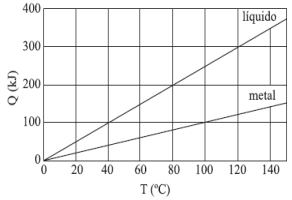
O bloco de metal, a 115 ºC, foi colocado em contato com o líquido, a 10 ºC, em um recipiente ideal e isolado termicamente. Considerando que ocorreu troca de calor somente entre o bloco e o líquido, e que este não se evaporou, o equilíbrio térmico ocorrerá a
- A) 40 ºC.
- B) 55 ºC.
- C) 50 ºC.
- D) 60 ºC.
- E) 70 ºC.
A resposta certa é a letra B) 55°C.
Para entender essa resposta, é preciso analisar o gráfico fornecido. Nele, podemos ver que a quantidade de calor absorvido pelo metal e pelo líquido varia em função da temperatura. No entanto, é importante notar que o equilíbrio térmico é alcançado quando a temperatura do metal e do líquido se igualam.
No gráfico, vemos que a curva do metal cruza a curva do líquido em torno de 55°C. Isso significa que, nessa temperatura, a quantidade de calor absorvido pelo metal é igual à quantidade de calor absorvido pelo líquido. Portanto, é nessa temperatura que o equilíbrio térmico é alcançado.
Além disso, é importante lembrar que, como o metal e o líquido estão em contato em um recipiente ideal e isolado termicamente, não há perda de calor para o meio ambiente. Dessa forma, a única forma de troca de calor é entre o metal e o líquido. Como o líquido não se evaporou, a temperatura final alcançada é a temperatura de equilíbrio.
Portanto, a resposta certa é a letra B) 55°C, pois é a temperatura em que o equilíbrio térmico é alcançado entre o metal e o líquido.
