Questões Sobre Termologia - Física - concurso
Questão 661
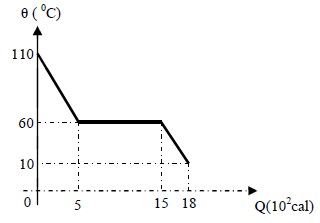
- A) 6 x 10-2 cal/g 0C, 1 x 10-1 cal/g 0C, 1 cal/g
- B) 1 x 10-1 cal/g 0C, 6 x10-1 cal/g 0C, 1 cal/g
- C) 1 x 10-1 cal/g 0C, 6 x10-2 cal/g 0C, 10 cal/g
- D) 1 x 10-3 cal/g 0C, 6 x10-2 cal/g 0C, 1 cal/g
- E) 1 x 10-2 cal/g 0C, 6 x10-2 cal/g 0C, 10 cal/g
Resposta: C) 1 x 10-1 cal/g 0C, 6 x 10-2 cal/g 0C, 10 cal/g
Para entender por que a alternativa C é a correta, vamos analisar o gráfico fornecido. O gráfico mostra a variação da temperatura sofrida por 100 gramas de um líquido durante um processo de resfriamento, em função da quantidade de calor retirada desse corpo.
Observe que o gráfico apresenta uma curva em forma de "S", indicando que a temperatura do líquido diminui à medida que o calor é retirado. Além disso, é possível identificar dois estados de mudança de fase no gráfico: uma primeira mudança de fase líquido-sólido e uma segunda mudança de fase sólido-líquido.
Para calcular o calor específico e o calor latente, precisamos entender que o calor específico é a quantidade de calor necessária para elevar a temperatura de um grau Celsius em um grama de substância, enquanto o calor latente é a quantidade de calor necessária para mudar o estado de fase de um grama de substância.
Analizando o gráfico, podemos identificar que o calor específico do líquido é de 1 x 10-1 cal/g 0C, pois essa é a inclinação da curva na região líquida. Já o calor específico do sólido é de 6 x 10-2 cal/g 0C, pois essa é a inclinação da curva na região sólida.
Em relação ao calor latente, podemos identificar que ele é de 10 cal/g, pois essa é a quantidade de calor necessária para mudar o estado de fase do líquido para o sólido.
Portanto, a alternativa C é a correta, pois apresenta os valores corretos para o calor específico do líquido, do sólido e do calor latente.
Questão 662

Nelas, está representada uma substância em estados físicos diferentes. Cada estado físico possui determinadas características. Assinale a alternativa que apresenta essa relação de forma correta.
- A) No estado sólido, a forma da substância é variável e o volume é constante.
- B) No estado líquido, a forma é variável e o volume é inconstante.
- C) No estado líquido, a forma é invariável e o volume é constante.
- D) No estado gasoso, a forma e o volume são invariáveis.
- E) No estado sólido, a forma é invariável e o volume é constante.
A resposta certa é a letra E) No estado sólido, a forma é invariável e o volume é constante.
Para entender por que essa é a resposta certa, vamos analisar as características dos estados físicos. No estado sólido, as partículas estão muito próximas entre si e têm uma forma definida, portanto, a forma da substância é invariável. Além disso, as partículas estão muito próximas e não podem se mover livremente, então o volume da substância também é constante.
As outras opções estão erradas porque:
- A) No estado sólido, a forma da substância é invariável, mas o volume pode variar.
- B) No estado líquido, a forma da substância é variável e o volume é inconstante.
- C) No estado líquido, a forma da substância é invariável, mas o volume é variável.
- D) No estado gasoso, a forma e o volume da substância são variáveis.
Portanto, a resposta certa é a letra E) No estado sólido, a forma é invariável e o volume é constante.
663) Julgue o item a seguir:
- A) Certo
- B) Errado
Resposta: B) Errado
Vamos analisar a situação proposta. Temos 1 kg de água a 0°C que será aquecida por um aquecedor elétrico de potência 1 kW. A questão pergunta se a ebulição ocorrerá dois minutos após o aquecedor ser ligado.
Para responder a essa pergunta, precisamos calcular a quantidade de calor necessária para aumentar a temperatura da água de 0°C até o ponto de ebulição (100°C). Sabemos que a capacidade calorífica específica da água é de aproximadamente 4186 J/kg°C.
Vamos calcular a variação de temperatura: ΔT = 100°C - 0°C = 100°C.
Agora, podemos calcular a quantidade de calor necessária: Q = m × c × ΔT, onde m é a massa de água (1 kg) e c é a capacidade calorífica específica da água.
Q = 1 kg × 4186 J/kg°C × 100°C = 418600 J
Como o aquecedor elétrico tem uma potência de 1 kW (ou seja, 1000 J/s), podemos calcular o tempo necessário para fornecer essa quantidade de calor:
t = Q / P = 418600 J / 1000 J/s = 418,6 s
Convertendo esse tempo para minutos, temos: t ≈ 6,98 minutos
Portanto, não é possível que a ebulição ocorra dois minutos após o aquecedor ser ligado, pois o tempo necessário para fornecer a quantidade de calor necessária é maior do que isso. Logo, a resposta certa é B) Errado.
664) Analise os itens abaixo e indique (V) para os itens verdadeiros e (F) para os itens falsos, assinalando a alternativa correta.
- A) V – V – V
- B) V – F – V
- C) V – V – F
- D) F – F – V
- E) F – V – F
A alternativa correta é letra C) V – V – F
Vamos verificar afirmativa por afirmativa.
I – Calor é o nome dado à energia térmica quando ela é transferida de um corpo a outro.
CORRETA. Pessoal, guardem isso para não errar mais: "calor é energia em fluxo".
II – Temperatura é a grandeza física que permite medir quanto um corpo está quente ou frio. CORRETA. Apesar do termo quente e frio serem subjetivos. Acredito que aqui a questão pecou um pouco.
Digo isso porque quando sentimos algo calor ou frio isso tem mais a ver com o fluxo de calor que o corpo percebe. Exemplo: um copo d`'agua na sua cozinha está a mesma temperatura que o ar. Porém, a água parece mais gelada que o ar quando você a consome. Isso porque o fluxo de calor é maior (ela tem mais condutividade térmica).
Sendo bem técnico a questão não foi muito precisa.
III – O calor e a temperatura podem ser armazenados. ERRADA. Calor é fluxo pessoal.
Justificativa do gabarito fornecida pela banca:
Gabarito: Letra C
O calor e a temperatura não podem ser armazenados. Referencia: Ciências e Educação Ambiental – Química e Física - Daniel Cruz – 8ª série – Pag. 192 e 193.
Gabarito: LETRA C.
665) Analise os itens abaixo e indique (V) para os itens verdadeiros e (F) para os itens falsos, assinalando a alternativa correta.
- A) F – V – V
- B) V – F – F
- C) F – F – V
- D) V – V – V
- E) F – F – F
A alternativa correta é letra A) F – V – V
Vamos verificar afirmativa por afirmativa pessoal.
I – Como o calor é uma forma de energia, a unidade de quantidade de calor no Sistema Internacional de Unidades é a caloria (cal), unidade de energia. No entanto, a unidade mais usada, na prática, é o joule.
ERRADA. Pessoal os conceitos foram invertidos. O joule é S.I., enquanto o cal utilizado mais no dia a dia.
II – Caloria é a quantidade de calor necessária para elevar de 1 ºC (entre 14,5 ºC e 15,5 ºC) a temperatura de 1 grama de água.
CORRETA. É essa a definição de caloria.
III – Uma caloria é igual a 4,8 joules. CORRETA. Em alguns exercícios vemos ela como 4,19 J. Porém não está errado pois depende do caso.
Justificativa do gabarito fornecida pela banca:
Gabarito: Letra A
Como o calor é uma forma de energia, a Unidade de quantidade de calor no Sistema Internacional de Unidades é o joule, unidade de energia. No entanto, a unidade mais usada, na prática, é a caloria (cal). Referencia: Ciências e Educação Ambiental – Química e Física - Daniel Cruz – 8ª série – Pag. 196.
Gabarito: LETRA A.
666) Certa barra de aço a 50 ºC possui um comprimento de 1 m. Uma barra de alumínio, a uma temperatura de 20 ºC, também medindo 1 m de comprimento, é colocada em contato com a primeira e o sistema composto pelas duas barras é isolado termicamente do ambiente. Os coeficientes de dilatação térmica linear do aço e do alumínio são, respectivamente, 11 x 10–6 ºC –1 e 23 x 10–6 ºC –1.
- A) aço estará menor que a barra de alumínio, por possuir menor coeficiente de dilatação térmica.
- B) aço estará menor que a barra de alumínio, porque sua temperatura diminui, enquanto a da barra de alumínio aumenta.
- C) alumínio estará menor que a barra de aço, por possuir maior coeficiente de dilatação térmica.
- D) alumínio estará menor que a barra de aço, porque sua variação de temperatura será maior que a do aço.
Resposta: A alternativa correta é B) a barra de aço estará menor que a barra de alumínio, porque sua temperatura diminui, enquanto a da barra de alumínio aumenta.
Para entender melhor, vamos analisar o problema. Inicialmente, a barra de aço tem uma temperatura de 50°C e a barra de alumínio tem uma temperatura de 20°C. Quando as barras são colocadas em contato, o sistema atinge o equilíbrio térmico. Nesse estado, a temperatura das barras será a mesma.
Como o coeficiente de dilatação térmica linear do aço é 11 × 10-6 °C-1 e do alumínio é 23 × 10-6 °C-1, podemos concluir que a barra de alumínio se expandirá mais do que a barra de aço quando a temperatura aumenta.
Portanto, como a temperatura da barra de aço diminuiu para atingir o equilíbrio térmico, sua expansão foi menor do que a da barra de alumínio. Isso significa que a barra de aço estará menor que a barra de alumínio.
667) O calor específico de uma dada substância é c=130{large{J over kg.ºC}}. Um bloco composto dessa substância possui massa m = 2 kg e está a uma temperatura inicial de 4,5 ºC. Sobre ele, é realizado trabalho igual a 230 J e, simultaneamente, transferidos 160 J de calor. A temperatura final desse bloco será de
- A) 0,33 ºC.
- B) 1,5 ºC.
- C) 4,5 ºC.
- D) 6 ºC.
A resposta correta é D) 6°C.
Vamos analisar a questão passo a passo. Primeiramente, temos que o calor específico da substância é c = 130 J/(kg°C). Isso significa que para uma variação de temperatura de 1°C, a substância absorve ou libera 130 J de calor por quilograma de massa.
Em seguida, temos que a massa do bloco é m = 2 kg e a temperatura inicial é T_i = 4,5°C. Além disso, sabemos que sobre o bloco foi realizado um trabalho de 230 J e, simultaneamente, foram transferidos 160 J de calor.
Para encontrar a temperatura final do bloco, precisamos aplicar a equação de variação de temperatura em função do calor específico:
ΔT = Q / (m × c), onde Q é o calor total absorvido ou liberado pelo bloco.
No nosso caso, o calor total é a soma do trabalho realizado e do calor transferido, ou seja, Q = 230 J + 160 J = 390 J. Substituindo os valores, temos:
ΔT = 390 J / (2 kg × 130 J/(kg°C)) = 1,5°C
Para encontrar a temperatura final, basta somar a variação de temperatura à temperatura inicial:
T_f = T_i + ΔT = 4,5°C + 1,5°C = 6°C
Portanto, a temperatura final do bloco é de 6°C, que é a alternativa D.
Questão 668
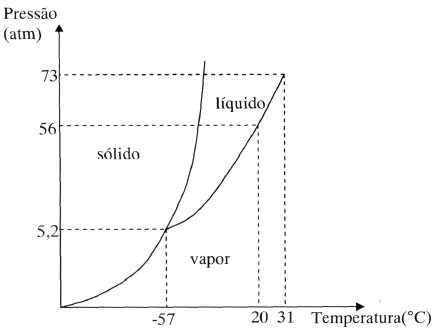
Uma dada quantidade de CO2, inicialmente à pressão de 1 atm e temperatura de 15 ºC, é submetida às seguintes transformações: uma transformação isotérmica até a pressão de 60 atm, seguida de uma redução isobárica da temperatura até –70 ºC e, posteriormente, uma redução de isotérmica de pressão até 6 atm.
É CORRETO afirmar que, nessas transformações, o CO2 irá passar, sequencialmente, pelas seguintes fases:
- A) vapor, sólido, líquido e vapor.
- B) vapor, líquido, sólido e vapor.
- C) vapor, líquido e sólido.
- D) líquido e sólido.
A resposta correta é a letra C) vapor, líquido e sólido.
Para entender por que essa é a resposta correta, vamos analisar as transformações sofridas pelo CO2 nas condições dadas.
Inicialmente, o CO2 encontra-se a uma pressão de 1 atm e temperatura de 15°C. Em seguida, é submetido a uma transformação isotérmica até a pressão de 60 atm. Nessa etapa, o CO2 está no estado de vapor.
Em seguida, ocorre uma redução isobárica da temperatura até -70°C. Nessa etapa, o CO2 condensa e passa para o estado líquido.
Por último, ocorre uma redução isotérmica da pressão até 6 atm. Nessa etapa, o CO2 pode passar para o estado sólido, uma vez que se encontra abaixo da curva de fusão do diagrama de fases.
Portanto, durante essas transformações, o CO2 passou sequencialmente pelos estados de vapor, líquido e sólido, o que corrobora a alternativa C) como a resposta correta.
669) Considere os seguintes objetos: o Sol, a lava de um vulcão e uma folha de papel. É CORRETO afirmar que
- A) apenas o Sol emite energia radiante.
- B) todos eles emitem energia radiante.
- C) o Sol e a lava emitem energia radiante.
- D) nenhum deles emite energia radiante.
A alternativa correta é a letra B) todos eles emitem energia radiante.
Isso ocorre porque todos os objetos, independentemente de sua temperatura, emitem radiação eletromagnética, que é conhecida como radiação térmica. A radiação térmica é uma forma de energia que é emitida por todos os corpos que possuem temperatura maior que 0 K (-273°C).
No caso do Sol, a lava do vulcão e a folha de papel, todos eles possuem temperaturas acima de 0 K, portanto, emitem radiação térmica. O Sol, por ser uma estrela, tem uma temperatura muito alta, cerca de 5500°C, o que faz com que ele emita uma grande quantidade de energia radiante.
A lava do vulcão também tem uma temperatura muito alta, cerca de 1000°C, o que faz com que ela emita uma grande quantidade de energia radiante. Já a folha de papel, mesmo possuindo uma temperatura mais baixa, cerca de 20°C, ainda assim emite radiação térmica, embora em menor quantidade.
Portanto, é correto afirmar que todos os objetos, incluindo o Sol, a lava do vulcão e a folha de papel, emitem energia radiante.
É importante notar que a quantidade de energia radiante emitida depende da temperatura do objeto. Quanto mais alta a temperatura, mais energia radiante é emitida.
Além disso, é importante destacar que a radiação térmica é uma forma de transferência de energia que ocorre entre os corpos, sem a necessidade de contato físico entre eles.
Essa é a razão pela qual a alternativa correta é a letra B) todos eles emitem energia radiante.
670) Uma máquina de Carnot opera entre duas fontes, uma quente, à temperatura T_q , e uma fria, à temperatura T_f . Sabe-se que esta máquina recebe uma quantidade de calor Q_1=10.000 J da fonte quente e despeja uma quantidade Q_1=4000 J na fonte fria. Se a temperatura da fonte quente é T_q=600 K, então a temperatura da fonte fria é:
- A) 100K;
- B) 240K;
- C) 300K;
- D) 360K;
- E) 400K.
Para resolver essa questão, precisamos aplicar a fórmula da eficiência de Carnot, que é dada por:
$$eta = 1 - frac{T_f}{T_q}$$Onde η é a eficiência da máquina de Carnot, T_f é a temperatura da fonte fria e T_q é a temperatura da fonte quente.
No problema, sabemos que a máquina de Carnot opera entre duas fontes, uma quente com temperatura T_q = 600 K e uma fria com temperatura T_f. Além disso, sabemos que a máquina recebe uma quantidade de calor Q_1 = 10.000 J da fonte quente e despeja uma quantidade de calor Q_2 = 4000 J na fonte fria.
Podemos começar calculando a eficiência da máquina de Carnot:
$$eta = frac{Q_1 - Q_2}{Q_1} = frac{10.000 J - 4000 J}{10.000 J} = 0,6$$Agora, podemos aplicar a fórmula da eficiência de Carnot para encontrar a temperatura da fonte fria:
$$0,6 = 1 - frac{T_f}{600 K}$$Resolvendo para T_f, obtemos:
$$T_f = 240 K$$Portanto, a alternativa correta é a letra B) 240 K.
Essa resposta é coerente com a teoria de Carnot, que estabelece que a eficiência de uma máquina térmica é limitada pela razão entre as temperaturas da fonte quente e da fonte fria.
