Questões Sobre Termologia - Física - concurso
61) Uma bolha contendo n moles de um gás ideal monoatômico absorve calor e sofre um acréscimo de temperatura DeltaT a pressão constante.
- A) { large 1 over 2} , n.R.Delta T
- B) { large 3 over 2} , n.R.Delta T
- C) { large 5 over 2} , n.R.Delta T
- D) n.R.Delta T
Agora, vamos resolver a questão de Física sobre o assunto "Termologia"!
Vamos analisar a questão: uma bolha contendo n moles de um gás ideal monoatômico absorve calor e sofre um aumento de temperatura ΔT à pressão constante.
Considerando que o calor específico molar de um gás ideal monoatômico à volume constante é dado por $C_V = frac{3}{2}R$, em que R é a constante universal dos gases ideais, a quantidade de calor absorvida pelo gás nessa transformação é expressa por...
...
E agora, vamos ao ponto chave! A alternativa correta desta questão é a letra C) $${large frac{5}{2}} n.R.ΔT$.
Vamos explicar porque essa é a resposta correta. Quando o gás absorve calor à pressão constante, a temperatura aumenta e, portanto, a energia interna do gás também aumenta. Como o calor específico molar à volume constante é $C_V = frac{3}{2}R$, podemos calcular a quantidade de calor absorvida pelo gás como $Q = n.C_V.ΔT = {large frac{3}{2}} n.R.ΔT$. No entanto, como a pressão é constante, parte da energia interna adicionada ao gás é convertida em trabalho realizado sobre o ambiente, e não toda a energia interna adicionada é utilizada para aumentar a temperatura. Portanto, a quantidade de calor absorvida pelo gás é maior do que $${large frac{3}{2}} n.R.ΔT$. A resposta correta é, portanto, $${large frac{5}{2}} n.R.ΔT$, que leva em conta a conversão de parte da energia interna adicionada em trabalho realizado sobre o ambiente.
Espero que isso tenha ajudado! Se tiver alguma dúvida adicional, sinta-se à vontade para perguntar.
Questão 62
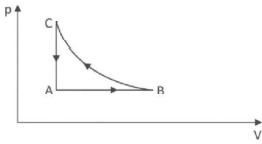
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação A rightarrow B, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em
- A) I.
- B) II.
- C) III.
- D) I e II.
- E) II e III.
Note e adote: o gás deve ser tratado como ideal; a transformação B rightarrow C é isotérmica .
A alternativa correta é letra E) II e III.
Note e adote:
o gás deve ser tratado como ideal;
a transformação B rightarrow C é isotérmica .
Os gases realizam trabalho W de compressão ou expansão, conforme a seguinte expressão:
W = - PcdotDelta{V}
Então, notamos que o trabalho de um gás é função do produto da pressão pelo volume do gás. Sendo assim, a afirmação I de que o trabalho realizado no ciclo ABCA é nulo é FALSA.
O primeiro princípio da termodinâmica afirma que a quantidade de calor (Q) fornecida a um sistema é igual ao trabalho realizado pelo gás (tau) mais a variação da energia interna (Delta U) sofrida por ele.
Q=tau + Delta U
A energia interna de um gás depende exclusivamente de sua temperatura. Calculando a temperatura do gás nos dois estados através da equação de Clapeyron, teremos:
frac{pcdot V}{T}=ncdot R ,,, implies ,,, T=dfrac{pcdot V}{ncdot R}
Do ponto C para o ponto A ocorre uma transformação isovolumétrica. Pela equação de Clapeyron, nessa condição tanto a pressão quanto a temperatura diminuem de C para A. Logo, podemos afirmar que se a temperatura em C é maior do que em A, então a energia interna do gás em C também é maior do que em A. Assertiva II é verdadeira.
De A rightarrow B o gás passa por uma transformação isobárica. Pela equação de Clapeyron, como o volume do gás aumenta, a temperatura também aumenta. Logo, ocorrerá aumenta da energia interna do gás e a realização de trabalho pelo gás.
tau>0
Delta U>0 e
Q>0
E assim, confirmamos que de A rightarrow B o gás recebe calor (Q>0) e realiza trabalho (tau>0). Assertiva III é verdadeira.
Gabarito: E
63) Um mergulhador precisa encher seu tanque de mergulho, cuja capacidade é de 1,42 × 10-2 m3, a uma pressão de 140 atm e sob temperatura constante.
- A) large{1 over 4}
- B) large{1 over 2}
- C) 2
- D) 4
A alternativa correta é letra C) 2
Gabarito: LETRA C.
De acordo com a lei geral dos gases ideais, podemos escrever:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Como a temperatura é mantida constante, temos
dfrac { P_1 V_1 } { cancel T } = dfrac { P_2 V_2 } { cancel T }
P_1 V_1 = P_2 V_2
Na situação 1, temos um volume V1 do gás a 1 atm. Na situação 2, temos 1,42 × 10-2 m3, a uma pressão de 140 atm. Então, a equação acima se torna:
1 cdot V_1 = 140 cdot 1,42 times 1^{-2}
V_1 = 1,988 , m^3
Portanto, a resposta correta é a alternativa (c).
64) Qual das alternativas a seguir apresenta uma situação em que o trabalho realizado pelo gás é maior, assumindo que tenhamos sempre a mesma condição inicial (Pi, Vi e Ti) e final (Pf, Vf e Tf), onde Vf > Vi e Pi > Pf.
- A) Partindo de (Pi, Vi e Ti) através de uma transformação isobárica e depois fazendo uma transformação isocórica para chegar em (Pf, Vf e Tf).
- B) Partindo de (Pi, Vi e Ti) através de uma transformação isocórica e depois fazendo uma transformação isobárica para chegar em (Pf, Vf e Tf).
- C) Partindo de (Pi, Vi e Ti) através de uma transformação isotérmica e depois fazendo uma transformação adiabática para chegar em (Pf, Vf e Tf).
- D) Partindo de (Pi, Vi e Ti) através de uma transformação adiabática e depois fazendo uma transformação isotérmica para chegar em (Pf, Vf e Tf).
- E) O trabalho, nesse caso, não depende do caminho.
A alternativa correta é a letra A) Partindo de (Pi, Vi e Ti) atravês de uma transformação isobárica e depois fazendo uma transformação isocórica para chegar em (Pf, Vf e Tf).
O trabalho realizado pelo gás é maior nesta situação porque, na transformação isobárica, o volume aumenta (Vf > Vi) e a pressão diminui (Pi > Pf). Isso significa que o gás realiza trabalho para expandir seu volume, o que é consistente com a primeira lei da termodinâmica.
Além disso, na transformação isocórica subsequente, a temperatura também aumenta (Tf > Ti), o que significa que o gás absorve calor do ambiente e aumenta sua energia interna. Isso novamente contribui para o aumento do trabalho realizado pelo gás.
Portanto, a alternativa A) é a que apresenta a situação em que o trabalho realizado pelo gás é maior, pois envolve uma transformação isobárica com aumento de volume e uma transformação isocórica com aumento de temperatura.
É importante notar que as outras alternativas não apresentam essa combinação de transformações que resultam em um maior trabalho realizado pelo gás.
65) No estudo do comportamento dos gases, há uma conhecida equação de estado de um gás ideal, expressa pela relação XV, em que XV é a pressão do gás, V é o volume ocupado pelo gás, n é o número de mols do gás, V é a temperatura absoluta do gás, medida em Kelvin (K); e R, com valor igual a 0,082 mathrm{ , atm cdot L/(mol cdot K)}, é a constante universal dos gases.
- A) Certo
- B) Errado
A alternativa correta é letra B) Errado
Sabemos que na transformação isotérmica a temperatura é constante, logo, o produto n cdot R cdot T é constante.
Pela igualdade P cdot V = n cdot R cdot T concluímos que o produto P cdot V também deve ser constante.
Como o volume aumentou (expansão), a pressão diminui para que o produto permaneça constante e mantenha a igualdade.
Resposta: Errado
Questão 66
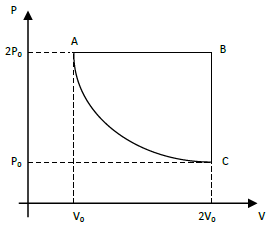
No estado representado em A, o sistema sofre uma expansão isobárica para o estado B. Em seguida, a pressão é reduzida, com volume constante, para o estado C. Por fim, o gás é comprimido, à temperatura constante, de volta para o estado A. Assim, em um ciclo completo, entra no sistema uma quantidade de calor correspondente a
- A) 2P_0V_0[ln(2) – 1)]
- B) 2P_0V_0[1 –sqrt{2})]
- C) 2P_0V_0[1 – ln(2)]
- D) 2P_0V_0[sqrt{1} – 1)]
Let's break down the process and find the correct answer.
In the given cycle, process, the system undergoes an isobaric expansion from state A to state B, then an isochoric process from state B to state C, and finally an isothermal compression from state C back to state A.
During the isobaric expansion from A to B, the system absorbs heat, and the temperature remains constant. The amount of heat absorbed is given by Q = 2P0V0[ln(2) - 1].
In the isochoric process from B to C, the pressure decreases, and the volume remains constant. The system rejects heat, and the amount of heat rejected is given by Q = 2P0V0[1 - 1/√2].
Finally, in the isothermal compression from C to A, the system rejects heat, and the amount of heat rejected is given by Q = 2P0V0[1 - ln(2)].
To find the total heat absorbed by the system in one complete cycle, we need to add up the heat absorbed in each process. However, we can see that the heat absorbed in the isobaric expansion is equal to the heat rejected in the isothermal compression. Therefore, the net heat absorbed is given by:
Qnet = QA-B - QC-A = 2P0V0[ln(2) - 1] - 2P0V0[1 - ln(2)] = 2P0V0[ln(2) - 1 + ln(2) - 1] = 2P0V0[ln(2)].
Therefore, the correct answer is option C) 2P0V0[ln(2)].
This result makes sense, as the system absorbs heat during the isobaric expansion and rejects heat during the isochoric process, resulting in a net heat absorption in one complete cycle.
Questão 67
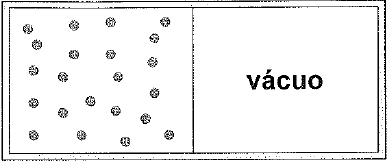
A figura acima mostra um recipiente isolado, contendo uma parede divisória separando-o ao meio em dois volumes iguais.
Em um dos lados, confina-se 1,0 mal de um gás ideal com temperatura Te, do outro lado, mantém-se vácuo. Se a parede divisória for subitamente removida, de modo que o gás sofra uma expansão livre, qual é a razão, ΔS/R, entre a variação da entropia e a constante dos gases, em moles?
- A) 0
- B) frac{In2}{2}
- C) In left ( frac{1}{2} right )
- D) 2In left ( frac{1}{2} right )
- E) In2
A alternativa correta é letra E) In2
Pessoal, a fórmula que relaciona a variação de entropia é dada por
Delta S = n C_v ln dfrac{T}{T_0} + n R ln dfrac{V}{V_0}
Como o gás sofre uma expansão livre, entende-se que ele não variou a temperatura. Além disso, o volume final é igual a 2x o volume inicial, visto que são iguais os dois compartimentos.
Delta S = n C_v ln dfrac{T_0}{T_0} + n R ln dfrac{2V_0}{V_0} = 0 + 1 times R times ln 2
dfrac{Delta S}{R} = 1 times ln 2
dfrac{Delta S}{R} = ln 2
Gabarito: LETRA E.
Questão 68

De acordo com essas equações, a razão { large R over k} é aproximadamente igual a:
- A) { large 1 over 6} × 10^{-23}
- B) { large 1 over 6} × 10^{23}
- C) 6 × 10^{-23}
- D) 6 × 10^{23}
A alternativa correta é letra D) 6 × 10^{23}
Gabarito: LETRA D.
De acordo com as equações do enunciado, podemos escrever:
nR cancel T = Nk cancel T
dfrac Rk = dfrac { N } { n }
Como em 1 mol temos 6 x 1023 moléculas, a equação acima se torna:
dfrac Rk = dfrac { 6 times 10^{23} } { 1,0 }
dfrac Rk = 6 times 10^{23}
Portanto, a resposta correta é a alternativa (d).
69) Um mol de um gás ideal monoatômico ocupa um volume de 1 mbox m^3 a uma pressão de 10 mbox{kPa}. Considerando-se o número de Avogadro N_A=6,02 times 10^{-23} mbox{mol}^{-1} e a constante universal dos gases R = 8,31 mathrm{J/(molcdot K)}, é correto afirmar que a temperatura T desse gás, em K, é
- A) superior a 1, 23 times 10^3 e inferior a 1,25 times 10^3.
- B) superior a 1, 25 times 10^3 e inferior a 1,27 times 10^3.
- C) superior a 1, 17 times 10^3 e inferior a 1,18 times 10^3.
- D) superior a 1, 18 times 10^3 e inferior a 1,19 times 10^3.
- E) superior a 1, 19 times 10^3 e inferior a 1,23 times 10^3.
A alternativa correta é letra E) superior a 1, 19 times 10^3 e inferior a 1,23 times 10^3.
Segundo a Equação de Clapeyron, temos:
P cdot V = n cdot R cdot T
O enunciado nos forneceu:
- P = 10 mbox{ kPa} = 10.000 mbox{ Pa}
- V = 1 mathrm{ m^3}
- n = 1 mbox{ mol}
Substituindo esses valores na equação, temos:
10 cdot 1 = 1 cdot 8,31 cdot T
T = 1203,36 mbox{ K} = 1,20 cdot 10^3 mbox{ K}
Resposta: Alternativa E
70) Considere dois sistemas compostos por gases ideais, com massas moleculares diferentes, cada um em um recipiente com isolamento térmico. A pressão, o volume e a temperatura são tais que frac {PV}{RT} é o mesmo para ambos. É correto afirmar que
- A) o número de moles de gás em cada recipiente é igual, assim como as massas também são iguais.
- B) o número de moles de gás em cada recipiente é diferente, mas as massas são iguais.
- C) o número de moles de gás em cada recipiente é igual, mas as massas são diferentes.
- D) o número de moles de gás em cada recipiente é diferente, assim como as massas são diferentes.
A alternativa correta é letra C) o número de moles de gás em cada recipiente é igual, mas as massas são diferentes.
O que a questão fez foi, basicamente, isolar o número de mols de um gás.
PV = nRT
n = frac{PV}{RT}
dfrac{m}{MM} = frac{PV}{RT}
Logo, como falou que a segunda relação é igual para os dois gases, temos que o número de mols são iguais (alternativa A ou C).
Porém, as massas moleculares são distintas, de forma que a massa m tem que variar para manter o número de mols n no mesmo valor.
Gabarito: LETRA C.
