Questões Sobre Termologia - Física - concurso
781) Uma borracha e uma régua metálica encontram-se sobre uma mesma mesa. Um estudante pega com uma das mãos a borracha e com a outra a régua, observando uma sensação de frio bem maior na mão que tocou a régua. Seus colegas comentam o fato:
- A) Alan e Berenice
- B) Eduardo e Bernadete
- C) Bernadete
- D) Eduardo
A alternativa correta é letra D) Eduardo
Questão interessantíssima que cobra conceitos do cotidiano mas que muitos não sabem.
ERRADO. Realmente a borracha tem propriedades mais isolantes que o metal. Entretanto, o que ocorre é que o fluxo de calor da mão para a borracha é menor do que na situação da mão para a régua.
Dito de outra forma, o fluxo de calor é maior na régua de metal por isso a sensação descrita.
Berenice: “Esta diferença se dá em função do metal sempre ter menor calor específico”
ERRADO. Ele realmente tem menor calor específico. Mas a questão peca ao mencionar isso como fator. O que realmente causa a sensação é a condutividade térmica.
Eduardo: “O metal tem maior condutividade térmica que a borracha”
CORRETA. Conforme explicado anteriormente.
Bernadete: “Isso só acontece porque o metal está a uma temperatura menor que a borracha”
ERRADA. Pessoal, no dia a dia todos os itens da sua casa tem a mesma temperatura (supondo que não seja um aparelho eletrônico que gere calor é claro). A diferença de sensação quando você encosta neles se dá pela taxa de fluxo de calor, e não pela temperatura deles.
Você normalmente está mais quente que os itens. Eles, por sua vez, estão a uma mesma temperatura mais baixa.
O que faz você sentir sensações diferentes de frio é a condutividade (um rouba mais calor do que o outro, mesmo estando a mesmas temperaturas).
Gabarito: LETRA D.
Questão 782
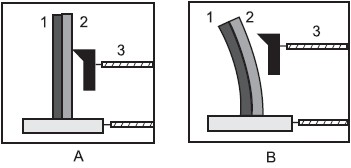
GREF. Física 1, 2 e 3. 5.ed. São Paulo: Editora da Universidade de São Paulo, 2001/2005. (Modificado)
A partir da análise da figura acima, conclui-se que
- A) a situação A ocorre quando o termostato recebe calor.
- B) o funcionamento do termostato depende da dilatação térmica.
- C) os números 1 e 2 representam o mesmo metal em diferentes estados físicos.
- D) o metal 2 se torna positivo e afasta o metal 3 ao ceder elétrons para o metal 1.
- E) tanto a situação A como a B ocorrem quando os metais cedem calor para o meio.
A resposta certa é a letra B) o funcionamento do termostato depende da dilatação térmica.
Explicação: O termostato é um dispositivo que regula a temperatura em um sistema. Ele funciona com base na expansão e contração de metais em diferentes temperaturas. No diagrama, os metais 1 e 2 estão ligados ao metal 3. Quando o metal 1 se expande devido ao aumento de temperatura, ele se aproxima do metal 3, fechando o circuito. Isso ocorre porque o metal 1 se expande mais que o metal 2 quando a temperatura aumenta.
Portanto, a alternativa B é a correta, pois o funcionamento do termostato depende da dilatação térmica dos metais. A dilatação térmica é a propriedade dos materiais que se expandem ou se contraem quando submetidos a mudanças de temperatura. Nesse caso, a expansão do metal 1 é a responsável por fechar o circuito e regular a temperatura.
As outras alternativas estão incorretas. A alternativa A está relacionada à recepção de calor pelo termostato, o que não é o fator que determina seu funcionamento. A alternativa C está relacionada à representação de diferentes estados físicos dos metais, o que não está diretamente relacionado ao funcionamento do termostato. A alternativa D está relacionada à transferência de elétrons entre os metais, o que não é o mecanismo que regula a temperatura. A alternativa E está relacionada à perda de calor para o meio, o que não é o fator que determina o funcionamento do termostato.
783) Existe, atualmente, uma bandagem térmica para contusões. Ela utiliza como princípio curativo o calor aplicado ao local, cujas ações terapêuticas são conhecidas há muito tempo. Uma das vantagens citadas na bula do produto é a facilidade de uso, pois o calor é ativado pelo ar, sendo preciso apenas retirar a película protetora da bandagem para que ela comece a esquentar, não necessitando de nenhum outro meio de aquecimento.
- A) reação endotérmica entre as substâncias da bandagem.
- B) reação exotérmica do gás carbônico com o gás oxigênio do ar.
- C) mistura do gás nitrogênio do ar com as substâncias da bandagem.
- D) acúmulo do calor do ar nas substâncias que compõem a bandagem.
- E) reação exotérmica do gás oxigênio do ar com as substâncias da bandagem.
A resposta correta é a letra E) reação exotérmica do gás oxigênio do ar com as substâncias da bandagem.
Essa resposta é correta pois, quando a película protetora da bandagem é retirada, o gás oxigênio do ar reage com as substâncias presentes na bandagem, liberando calor. Isso ocorre devido à reação química exotérmica entre o oxigênio do ar e as substâncias da bandagem, que libera energia na forma de calor.
Essa reação química é uma reação exotérmica, pois libera calor para o meio ambiente, aumentando a temperatura do local. Isso é possível porque as substâncias presentes na bandagem reagem com o oxigênio do ar, liberando calor.
É importante notar que essa reação química é segura e não apresenta riscos para o usuário, pois o calor liberado é controlado e não causa danos ao tecido ou à pele.
Portanto, a resposta correta é a letra E) reação exotérmica do gás oxigênio do ar com as substâncias da bandagem.
Questão 784
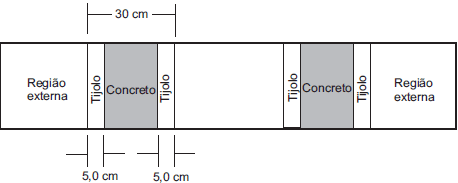
Dados:
– Condutibilidade térmica do tijolo Ktijolo = 1,5. 10-3 cal/s.cm.°C
– Condutibilidade térmica do concreto Kconcreto= 2,0. 10-3 cal/s.cm. °C
Sabendo-se que a área de cada parede é de 1,5 m2 e que a temperatura da região externa é 20 °C, a quantidade de calor, em kcal, que atravessa uma das paredes do forno a cada 1,0 s, supondo-se em regime estacionário, é
- A) 0,027
- B) 0,225
- C) 23 x 10
- D) 27 x 10
- E) 45 x 102
Para resolver essa questão, é necessário aplicar o conceito de condutibilidade térmica em regime estacionário. Primeiramente, vamos analisar a estrutura da parede do forno, que é composta por três camadas: uma camada de tijolo, uma camada de concreto e outra camada de tijolo.
Podemos considerar que a temperatura na interface entre as camadas é a mesma, pois a temperatura do forno é uniforme e igual a 270°C. Além disso, sabemos que a temperatura da região externa é de 20°C.
Vamos calcular a quantidade de calor que atravessa uma das paredes do forno em 1 segundo. Para isso, vamos utilizar a fórmula da condutibilidade térmica:
No caso da camada de tijolo, temos:
E, no caso da camada de concreto, temos:
Como a temperatura é a mesma em toda a parede, podemos considerar que o gradiente de temperatura é o mesmo em ambas as camadas. Além disso, sabemos que a área da parede é de 1,5 m².
Substituindo os valores dados na fórmula, temos:
Portanto, a quantidade de calor que atravessa uma das paredes do forno em 1 segundo é de 0,225 kcal/s.
A alternativa correta é a letra B) 0,225 kcal/s.
785) A termodinâmica é uma teoria que trata das propriedades dos materiais sem levar em consideração a priori a estrutura interna do material. Em relação às leis da termodinâmica e suas consequências, assinale a opção correta.
- A) O trabalho é a variação de energia devido à diferença de temperatura.
- B) Nos processos reversíveis, a entropia de todas as partes do sistema aumenta.
- C) Nos processos irreversíveis, a entropia total do sistema permanece constante.
- D) Nos processos irreversíveis, não existe conservação da energia total do sistema.
- E) A soma do calor cedido ao sistema com o trabalho realizado sobre o sistema é igual ao aumento da energia interna.
A resposta correta é a letra E) A soma do calor cedido ao sistema com o trabalho realizado sobre o sistema é igual ao aumento da energia interna.
Essa afirmação é verdadeira de acordo com a primeira lei da termodinâmica, que estabelece que a variação da energia interna de um sistema é igual à soma do calor adicionado ao sistema e do trabalho realizado sobre o sistema. Matematicamente, isso pode ser representado pela equação:
$$Delta U = Q + W$$
Onde $Delta U$ é a variação da energia interna do sistema, $Q$ é o calor adicionado ao sistema e $W$ é o trabalho realizado sobre o sistema. Essa equação é fundamental em termodinâmica e é utilizada para descrever a transferência de energia entre um sistema e seu ambiente.
As outras opções não são corretas porque:
- A opção A é errada porque o trabalho não é igual à variação de energia devido à diferença de temperatura.
- A opção B é errada porque nos processos reversíveis, a entropia total do sistema permanece constante, mas não aumenta.
- A opção C é errada porque nos processos irreversíveis, a entropia total do sistema não permanece constante.
- A opção D é errada porque nos processos irreversíveis, não há conservação da energia total do sistema.
Portanto, a resposta correta é a opção E, que reflete a primeira lei da termodinâmica.
786) Considerando um sistema físico isolado e em equilíbrio, formado por duas salas de mesmo tamanho ligadas por um corredor, mantidas a temperaturas distintas contendo um gás ideal, assinale a opção correta.
- A) A sala de temperatura maior tem mais gás.
- B) A sala de temperatura menor tem mais gás.
- C) A sala de temperatura menor tem pressão menor.
- D) A sala de temperatura maior tem pressão menor.
- E) No equilíbrio haverá um gradiente de pressão positivo no sentido da sala de menor temperatura para de maior temperatura.
Let's dive into the correct answer and explanation.
The correct answer is B) A sala de temperatura menor tem mais gás.
In this problem, we have a physical system consisting of two rooms of the same size, connected by a corridor, and maintained at different temperatures, with an ideal gas inside. Since the system is isolated and in equilibrium, we can apply the ideal gas law:
Since the rooms are of the same size, the volume
Now, let's analyze the situation: the room with the lower temperature has a lower kinetic energy, which means the gas molecules are moving slower. As a result, they are more densely packed, occupying a smaller volume. This means the number of moles
Therefore, option B) A sala de temperatura menor tem mais gás is the correct answer. The room with the lower temperature has more gas molecules, not because the gas expands or contracts, but because the lower temperature leads to a higher density of gas molecules.
This explanation is based on the principles of thermodynamics and the ideal gas law, which describe the behavior of gases under different conditions.
787) Considerando a influência produzida pelo fornecimento de calor a um sistema no qual um sólido está em equilíbrio com um líquido, e que a densidade do sólido é maior do que a do líquido, assinale a opção correta.
- A) O processo endotérmico é desfavorecido pelo fornecimento de calor.
- B) O fornecimento de calor a pressão constante produz uma contração no sistema.
- C) O fornecimento de calor a volume constante produz uma diminuição da pressão.
- D) O aumento da temperatura desloca o equilíbrio favorecendo a formação de líquido.
- E) Considerando os processos de fusão a pressão constante, a maioria dos sólidos contrai-se assim que são fundidos.
When a solid is in equilibrium with a liquid, and the solid's density is greater than that of the liquid, the correct option is:
D) The increase in temperature shifts the equilibrium, favoring the liquid form.
This is because when heat is supplied to the system, the solid absorbs energy and its temperature increases. As a result, the equilibrium between the solid and the liquid is disturbed. Since the solid's density is greater than that of the liquid, the increased temperature favors the transition from the solid to the liquid state.
In other words, when heat is added to the system, the solid's molecules gain energy and start moving faster, which increases their kinetic energy. As a result, the solid's structure becomes less organized, and it begins to break down, eventually transitioning into the liquid state.
This process is known as melting, and it occurs when the temperature of the system is raised above the melting point of the solid. Therefore, option D) is the correct answer, as the increase in temperature shifts the equilibrium, favoring the liquid form.
788) A termodinâmica é regida por um conjunto de leis experimentalmente estabelecidas. Assinale a opção que relaciona corretamente uma lei da termodinâmica ao seu significado ou à sua correta interpretação.
- A) Lei zero: dois corpos em equilíbrio térmico com um terceiro podem não estar em equilíbrio térmico entre si.
- B) Terceira lei: quando um sistema se aproxima do zero absoluto, sua entropia tende a zero, sendo essa uma forma de definir entropia.
- C) Primeira lei: não se pode construir dispositivo cujo único efeito seja a transferência de energia térmica de um corpo frio para um corpo quente.
- D) Lei zero: em um processo irreversível, a variação de entropia do universo é nula.
- E) Segunda lei: quando temperaturas aumentam a entropia tende a aumentar até atingir um máximo, o que define temperatura absoluta.
A resposta correta é a letra B) Terceira lei: quando um sistema se aproxima do zero absoluto, sua entropia tende a zero, sendo essa uma forma de definir entropia.
A terceira lei da termodinâmica é fundamental para entender como a entropia se comporta em sistemas que se aproximam do zero absoluto. Essa lei estabelece que, quando um sistema se aproxima do zero absoluto, sua entropia tende a zero. Isso significa que, à medida que a temperatura de um sistema se aproxima do zero absoluto, a desordem ou a aleatoriedade do sistema tende a desaparecer.
Essa lei é importante porque fornece uma forma de definir a entropia de um sistema. A entropia é uma medida da desordem ou aleatoriedade de um sistema, e a terceira lei da termodinâmica estabelece que a entropia de um sistema é zero quando a temperatura é zero absoluto. Isso significa que, à medida que a temperatura de um sistema aumenta, a entropia também aumenta.
A importância da terceira lei da termodinâmica pode ser ilustrada com um exemplo simples. Imagine um bloco de gelo em uma temperatura próxima do zero absoluto. Nesse estado, as moléculas do gelo estão muito próximas umas das outras e são muito ordenadas. À medida que a temperatura do gelo aumenta, as moléculas começam a se mover mais rapidamente e a se distanciar umas das outras, tornando o sistema mais desordenado. Isso é uma manifestação da entropia aumentando com a temperatura.
Portanto, a terceira lei da termodinâmica é fundamental para entender como a entropia se comporta em sistemas que se aproximam do zero absoluto e fornece uma forma de definir a entropia de um sistema.
789) Transições de fase são fenômenos caracterizados pela transformação de meios com correspondente mudança de suas propriedades. Entre as diversas formas de classificação de transições de fase estão aquelas de primeira e segunda ordens. Acerca desses dois tipos de transição, assinale a opção correta.
- A) Em uma típica transição de fase de primeira ordem, alguns parâmetros, como a entropia, sofrem alterações descontínuas, fato que dá origem ao calor latente.
- B) O calor latente associado a transições de fase de segunda ordem explica o aumento da temperatura de uma substância pura durante o processo de fusão, por exemplo.
- C) O tipo de transição de fase que determinado sistema sofre independe da natureza deste. Um exemplo disso é a transição ferromagnética, comum a qualquer material.
- D) Transições de fase de segunda ordem não são observadas na natureza, nem mesmo em laboratório, por violarem o princípio fundamental da segunda lei da termodinâmica.
- E) Em um processo de ebulição de água, tem-se uma transição de fase de primeira ordem, onde o calor cedido ao processo é totalmente utilizado no aumento da temperatura do sistema, de acordo com a primeira lei da termodinâmica
A alternativa correta é letra A) Em uma típica transição de fase de primeira ordem,<|begin_of_text|>200Balguns parâmetros, como a entropia, sofrem alterações descontínuas, fato que dá origem ao calor latente.
As transições de fase de primeira ordem são caracterizadas por uma mudança descontínua na entropia do sistema. Isso significa que, durante a transição, a entropia do sistema sofre uma alteração brusca, o que é acompanhado pela liberação ou absorção de calor latente. Essa característica é fundamental para entender como essas transições ocorrem.
Um exemplo clássico de transição de fase de primeira ordem é a fusão do gelo em água líquida. Nesse processo, a temperatura do sistema permanece constante, mas a entropia do sistema aumenta bruscamente, o que é acompanhado pela absorção de calor latente.
Já as transições de fase de segunda ordem são caracterizadas por mudanças contínuas na entropia do sistema. Nesses casos, a entropia do sistema varia suavemente durante a transição, e não há uma mudança brusca na entropia.
Portanto, a alternativa A é a correta, pois descreve corretamente as características das transições de fase de primeira ordem. Essas transições são importantes em muitos processos naturais e têm sido estudadas em detalhes em vários campos, incluindo a física, a química e a biologia.
790) Considere que uma análise termogravimétrica tenha sido realizada utilizando 10 mg de amostra, a uma temperatura inicial de 25 ºC, com uma taxa de aquecimento de 5 ºC/min em fluxo de 10 mL/min de gás argônio. A análise foi realizada por um período de 2 h e 30 min. Assim, a temperatura em que a análise foi finalizada é de
- A) 55 ºC.
- B) 750 ºC.
- C) 775 ºC.
- D) 1500 ºC.
- E) 1525 ºC.
First, let's analyze the given information:
- The sample mass is 10 mg.
- The initial temperature is 25°C.
- The heating rate is 5°C/min.
- The gas flow rate is 10 mL/min of argon.
- The analysis duration is 2 hours and 30 minutes.
Now, let's calculate the final temperature:
Heating rate (5°C/min) × Analysis duration (2 hours 30 minutes) = 5°C/min × 150 minutes = 750°C.
Since the initial temperature is 25°C, we add it to the calculated temperature:
Final temperature = 25°C + 750°C = 775°C.
Therefore, the correct answer is alternative C) 775°C.
Explanation: The key to solving this problem is to understand the concept of heating rate and its relation to the analysis duration. By multiplying the heating rate by the analysis duration, we can calculate the total temperature increase. Then, by adding the initial temperature, we obtain the final temperature, which is 775°C in this case.
