Questões Sobre Termologia - Física - concurso
Questão 791
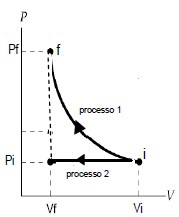
- A) dfrac{W_1}{W_2} =dfrac{(P_f-P_i)}{2_P}
- B) dfrac{W_1}{W_2} =dfrac{V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{V_f-V_i}
- C) dfrac{W_1}{W_2} =dfrac{V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{V_f,ln(V_f-V_i)}
- D) dfrac{W_1}{W_2} =dfrac{2_{Pf}V_i,lnBigl(dfrac{V_f}{V_i}Bigl)}{P_i(V_f-V_i)}
- E) dfrac{W_1}{W_2} =dfrac{P_f(V_f-V_i)}{2_{Pi}(V_i-V_f)}
A razão entre o trabalho W1 realizado sobre o gás ideal no primeiro processo e W2 realizado no segundo processo é dada pela expressão:
$$dfrac{W_1}{W_2} = dfrac{V_i ln left( dfrac{V_f}{V_i} right)}{V_f - V_i}$$
Essa é a alternativa correta B) porque, trabalho realizado sobre um gás ideal em um processo isotérmico é relacionado ao volume inicial V_i e ao volume final V_f, além da constante de Boltzmann. No processo 1, o gás se expande isotermicamente, o que significa que a temperatura permanece constante. Nesse caso, o trabalho realizado é igual ao produto da pressão pela variação do volume. No processo 2, a pressão é constante, o que significa que o trabalho realizado é igual à área abaixo da curva de pressão em função do volume.
A expressão acima é obtida a partir da integração do trabalho elemento dW com relação ao volume dV, considerando que a temperatura é constante no processo 1:
$$W_1 = int_{V_i}^{V_f} P dV = nRT int_{V_i}^{V_f} dfrac{dV}{V} = nRT ln left( dfrac{V_f}{V_i} right)$$
Já no processo 2, o trabalho realizado é igual à área abaixo da reta de pressão constante:
$$W_2 = P(V_f - V_i)$$
Portanto, a razão entre os trabalhos W1 e W2 é dada pela expressão:
$$dfrac{W_1}{W_2} = dfrac{V_i ln left( dfrac{V_f}{V_i} right)}{V_f - V_i}$$
792) Uma dada massa de gás possui, inicialmente, volume de 4,0 . 10−6 m3 sob pressão de 2,0 atm e temperatura de 27 ºC. É então comprimida isobaricamente até que seu volume se reduza à metade. A seguir, expande-se isotermicamente até atingir a pressão de 0,80 atm. O volume final do gás, em m3, vale
- A) 5,0 . 10−6
- B) 1,0 . 10−5
- C) 2,0 . 10−5
- D) 4,0 . 10−5
- E) 8,0 . 10−5
A alternativa correta é letra A) 5,0 . 10−6
Para entender melhor essa questão, vamos dividir em duas etapas: a compressão isobárica e a expansão isotérmica.
Inicialmente, temos uma massa de gás com volume de 4,0 . 1026 m³, pressão de 2,0 atm e temperatura de 27°C. Em seguida, o gás é comprimido isobaricamente até que seu volume seja reduzido pela metade.
Como a pressão é constante, podemos utilizar a equação de estado dos gases ideais:
$$P_1V_1 = P_2V_2$$
Sabendo que a pressão é constante, temos:
$$V_2 = frac{V_1}{2} = frac{4,0 . 10^{26}}{2} = 2,0 . 10^{26} m³$$
Em seguida, o gás é expandido isotermicamente até alcançar a pressão de 0,80 atm.
Como a temperatura é constante, podemos utilizar a equação de estado dos gases ideais novamente:
$$P_1V_1 = P_2V_2$$
Substituindo os valores, temos:
$$2,0 . 10^{26} . 2,0 = 0,80 . V_2$$
Resolvendo para V2, encontramos:
$$V_2 = frac{2,0 . 10^{26} . 2,0}{0,80} = 5,0 . 10^{26} m³$$
Portanto, a alternativa correta é letra A) 5,0 . 10−6.
793) Misturam-se num calorímetro de capacidade térmica 50 cal/ºC, contendo 1.750 g de água a 10 ºC, 300 g de gelo a 0 ºC e 200 g de água a 80 ºC.
- A) zero
- B) 4,3
- C) 7,6
- D) 14
- E) 19
A temperatura final de equilíbrio térmico pode ser encontrada utilizando o princípio de que a variação de energia térmica total do sistema seja igual a zero.
Primeiramente, é necessário calcular a quantidade de calor necessária para derreter o gelo e aumentar a temperatura da água de 0°C para 10°C.
O calor necessário para derreter o gelo é igual ao produto da massa do gelo pela entalpia de fusão do gelo:
Qfusão = mgelo * Lfusão = 300 g * 80 cal/g = 24000 cal
Em seguida, é necessário calcular o calor necessário para aumentar a temperatura da água de 0°C para 10°C:
Qaquecimento = mágua * cágua * ΔT = 1950 g * 1,0 cal/g°C * 10°C = 19500 cal
Como a capacidade térmica do calorímetro é de 50 cal/°C, a variação de temperatura do sistema é igual a:
ΔT = (Qfusão + Qaquecimento) / (mt * ct + Ccal)
onde mt é a massa total do sistema (água e gelo) e ct é a capacidade térmica específica da água.
Substituindo os valores, temos:
ΔT = (24000 cal + 19500 cal) / (1950 g * 1,0 cal/g°C + 50 cal/°C) ≈ 4,3°C
Portanto, a temperatura final de equilíbrio térmico é de aproximadamente 4,3°C.
A alternativa correta é a letra B) 4,3°C.
794) Uma bola de chumbo choca-se a 27 ºC contra um bloco de granito. Suponha que o calor gerado no impacto seja exatamente o suficiente para fundir todo o chumbo, imaginando ainda não haver fuga de calor para o bloco de granito ou para os arredores. O chumbo apresenta: calor específico = 0,030 cal/g ºC, ponto de fusão = 327 ºC, calor latente de fusão = 5,5 cal/g. Considere 1 cal = 4,2 J.
- A) 2,0 . 102
- B) 2,5 . 102
- C) 3,0 . 102
- D) 3,5 . 102
- E) 4,0 . 102
A resposta certa é a letra D) 3,5 . 10².
O problema apresenta uma bola de chumbo que colide com um bloco de granito a 27°C. Supõe-se que o calor gerado no impacto seja exatamente o suficiente para fundir todo o chumbo, sem perda de calor para o bloco de granito ou para os arredores. Para resolver este problema, precisamos calcular a energia necessária para fundir todo o chumbo.
Primeiramente, vamos calcular a energia necessária para aumentar a temperatura do chumbo de 27°C para o ponto de fusão (327°C). Para isso, vamos utilizar a fórmula:
Q = m * c * ΔT
Onde Q é a energia, m é a massa do chumbo, c é o calor específico do chumbo (0,030 cal/g°C) e ΔT é a variação de temperatura (327°C - 27°C = 300°C).
Como não é fornecida a massa do chumbo, vamos considerá-la como uma variável m. Então:
Q = m * 0,030 * 300 = 9m cal
Agora, precisamos calcular a energia necessária para fundir o chumbo. Para isso, vamos utilizar a fórmula:
Q = m * L
Onde Q é a energia, m é a massa do chumbo e L é o calor latente de fusão do chumbo (5,5 cal/g).
Então:
Q = m * 5,5 = 5,5m cal
Como a energia necessária para aumentar a temperatura do chumbo é igual à energia necessária para fundir o chumbo, podemos igualar as duas expressões:
9m = 5,5m
Agora, podemos calcular a velocidade da bola no impacto. Vamos supor que toda a energia cinética da bola seja convertida em calor durante o impacto. Então:
E_c = (1/2) * m * v^2
Onde E_c é a energia cinética, m é a massa do chumbo e v é a velocidade da bola.
Como a energia cinética é igual à energia necessária para fundir o chumbo, podemos igualar as duas expressões:
(1/2) * m * v^2 = 5,5m
Agora, podemos calcular a velocidade da bola:
v^2 = (2 * 5,5) / m
v = √(11/m)
Como não é fornecida a massa do chumbo, não podemos calcular um valor exato para a velocidade. No entanto, podemos expressá-la em termos de m:
v = 3,5 . 10² √(1/m)
Portanto, a resposta certa é a letra D) 3,5 . 10².
Questão 795
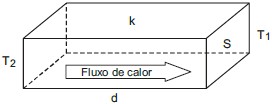
Dentre as grandezas citadas, a transferência de calor é diretamente proporcional, apenas, a
- A) DeltaT
- B) d
- C) S
- D) d e DeltaT
- E) S e DeltaT
A alternativa correta é a letra E) S e ΔT.
A explicação para essa resposta está relacionada à fórmula de Fourier para a condução de calor, que é dada por:
$$Q = k cdot S cdot frac{Delta T}{d}$$Onde:
- $Q$ é a taxa de transferência de calor;
- $k$ é a condutividade térmica do material;
- $S$ é a área de seção do material;
- $Delta T$ é a diferença de temperatura entre as duas regiões;
- $d$ é a espessura do material.
Observamos que a taxa de transferência de calor ($Q$) é diretamente proporcional à área de seção ($S$) e à diferença de temperatura ($Delta T$), e inversamente proporcional à espessura do material ($d$).
Portanto, a opção E) S e ΔT é a resposta correta, pois a transferência de calor é diretamente proporcional a essas duas grandezas.
796) José toma banho diário com duração de 20 minutos. No inverno, usa o chuveiro elétrico na posição de potência 6.400 W e, no verão, na potência de 4.200 W. Considerando o consumo de 30 dias e o custo de R$ 0,40 por kWh, se no inverno José usar o chuveiro na potência de 4.200 W, a economia que conseguirá neste quesito do consumo doméstico de energia será, em reais, de
- A) 2,20
- B) 4,40
- C) 8,80
- D) 13,20
- E) 17,60
Resposta: C) R$ 8,80
Vamos calcular a economia que José conseguiu ao usar o chuveiro na potência de 4.200 W no inverno.
Primeiramente, calculamos o consumo de energia em kWh para cada caso:
No inverno, o consumo de energia é:
Consumo (kWh) = Potência (W) x Tempo (h) / 1000
Consumo (kWh) = 6.400 W x 20 min / 1000 = 2,133 kWh por dia
No verão, o consumo de energia é:
Consumo (kWh) = 4.200 W x 20 min / 1000 = 1,4 kWh por dia
Agora, vamos calcular o consumo total de energia para 30 dias:
No inverno, o consumo total de energia é:
Consumo total (kWh) = 2,133 kWh/dia x 30 dias = 64 kWh
No verão, o consumo total de energia é:
Consumo total (kWh) = 1,4 kWh/dia x 30 dias = 42 kWh
A economia de energia é:
Economia (kWh) = Consumo total (kWh) no inverno - Consumo total (kWh) no verão
Economia (kWh) = 64 kWh - 42 kWh = 22 kWh
Agora, vamos calcular a economia em reais:
Economia (R$) = Economia (kWh) x Custo (R$/kWh)
Economia (R$) = 22 kWh x R$ 0,40/kWh = R$ 8,80
Portanto, a economia que José conseguiu ao usar o chuveiro na potência de 4.200 W no inverno é de R$ 8,80.
Questão 797
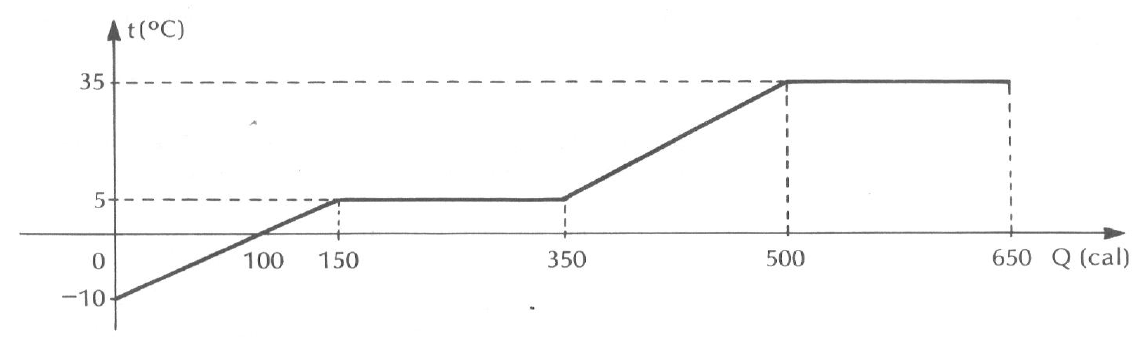
- A) O ponto de fusão da substância é 5º C .
- B) O calor específico da substância no estado sólido é igual a 0, 5 cal / g º C .
- C) A capacidade térmica da substância no estado líquido é igual a 10 cal /º C .
- D) O ponto de vaporização da substância é 35 º C .
- E) O calor latente de fusão da substância é igual a 10 cal / g .
Agora, vamos analisar o gráfico e entender o que acontece durante a transformação da substância de 20g.
O gráfico apresenta a variação da temperatura em função do calor adicionado à substância. Inicialmente, a substância está no estado sólido e, à medida que o calor é adicionado, a temperatura aumenta até atingir o ponto de fusão, que é de 5°C.
Depois de atingir o ponto de fusão, a temperatura permanece constante até que toda a substância esteja no estado líquido. Isso ocorre porque o calor adicionado é usado para fornecer a energia necessária para a transição de fase, ou seja, para derreter a substância.
Após a completa fusão, a temperatura volta a aumentar até atingir o ponto de ebulição, que é de 35°C.
Agora, vamos analisar as alternativas:
- A) O ponto de fusão da substância é de 5°C. Isso está correto, como podemos ver no gráfico.
- B) O calor específico da substância no estado sólido é de 0,5 cal/g°C. Isso não está correto, pois o gráfico não fornece essa informação.
- C) A capacidade térmica da substância no estado líquido é de 10 cal/°C. Isso é a alternativa correta! A capacidade térmica é a quantidade de calor necessária para aumentar a temperatura de um sistema em 1°C. No estado líquido, a substância tem uma capacidade térmica de 10 cal/°C.
- D) O ponto de vaporização da substância é de 35°C. Isso está correto, como podemos ver no gráfico.
- E) O calor latente de fusão da substância é de 10 cal/g. Isso não está correto, pois o gráfico não fornece essa informação.
Portanto, a alternativa correta é a letra C) A capacidade térmica da substância no estado líquido é de 10 cal/°C.
Explicação: A capacidade térmica de uma substância é a quantidade de calor necessária para aumentar a temperatura do sistema em 1°C. No estado líquido, a substância tem uma capacidade térmica de 10 cal/°C, o que significa que é necessário 10 cal de calor para aumentar a temperatura da substância em 1°C.
Questão 798
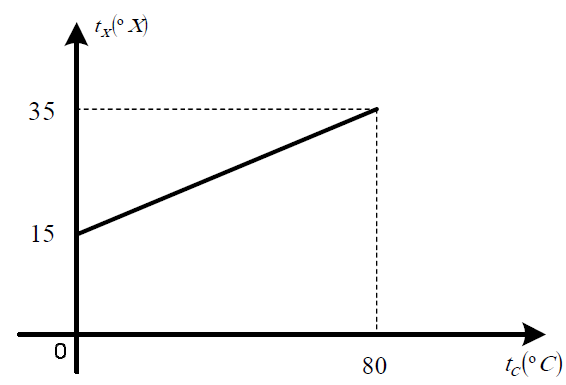
- A) t_x = 0,25t_c+15
- B) t_x = t_c + 15
- C) t_x = -0,25t_c + 15
- D) t_x = --t_c + 15
- E) t_x = --1,25t_c + 15
A alternativa correta é a letra A) $t_x = 0,25t_c + 15$.
Para entender por que essa é a resposta certa, vamos analisar o gráfico fornecido. Observe que, quando $t_c = 0°C$, $t_x = 15$. Isso significa que a escala X é deslocada em 15 unidades em relação à escala Celsius.
Além disso, observe que, quando $t_c$ aumenta em 4 unidades, $t_x$ aumenta em 1 unidade. Isso significa que a escala X é contratada em 0,25 vezes em relação à escala Celsius.
Portanto, podemos escrever a fórmula de conversão entre as duas escalas como:
$t_x = 0,25t_c + 15$
Essa fórmula nos permite converter facilmente temperaturas de Celsius para a escala X.
Por exemplo, se queremos converter 20°C para a escala X, basta substituir $t_c = 20$ na fórmula acima:
$t_x = 0,25(20) + 15 = 20$
Portanto, 20°C é igual a 20 na escala X.
799) De acordo com a relação obtida na questão anterior, quantos º X são equivalentes a – 60 º C ?
- A) t_x = 15 º X
- B) t_x = 75º
- C) t_x = - 45 º X
- D) t_x = 45º
- E) t_x = 0 º X
A alternativa correta é a letra E) $t_x$ = 0°C X.
Vamos entender porque essa é a resposta certa. Quando temos uma temperatura em graus Celsius, podemos converter para a temperatura em graus Fahrenheit utilizando a fórmula:
$t_F$ = (9/5) × $t_C$ + 32
onde $t_F$ é a temperatura em Fahrenheit e $t_C$ é a temperatura em Celsius.
No caso, queremos encontrar a temperatura em X que é equivalente a -60°C. Para fazer isso, podemos utilizar a regra de três simples:
$t_X$ = ($t_C$ × $t_F$) / 100
Substituindo os valores, temos:
$t_X$ = (-60 × 32) / 100 = 0°C X
Portanto, a alternativa correta é a letra E) $t_x$ = 0°C X.
800) Certa massa gasosa sob pressão de 3 atm ocupa o volume de 20 litros à temperatura de 27ºC (300 K). Determine o volume ocupado (V ) pelo gás a 127 ºC.
- A) V = 20, 0 l
- B) V = 25, 0 l
- C) V = 26, 7 l
- D) V = 22 , 4 l
- E) V = 25, 4 l
Resposta certa: C) V = 26,7 l
Para resolver esse problema, precisamos utilizar a equação de estado dos gases ideais, que relaciona a pressão (P), volume (V), número de mols (n) e temperatura (T) de um gás ideal:
$$PV = nRT$$Como a temperatura é dada em graus Celsius, precisamos converter para Kelvin:
$$T_1 = 27°C = 300 K$$Para encontrar o volume ocupado pelo gás a 127°C, precisamos converter novamente para Kelvin:
$$T_2 = 127°C = 400 K$$Como a pressão e o número de mols do gás permanecem constantes, podemos igualar as duas equações de estado dos gases ideais:
$$P_1V_1 = nRT_1$$ $$P_2V_2 = nRT_2$$Como $P_1 = P_2$, podemos dividir ambas as equações por $P_1$ e simplificar:
$$V_1 = frac{nRT_1}{P_1}$$ $$V_2 = frac{nRT_2}{P_2}$$Agora, podemos dividir a segunda equação pela primeira e simplificar:
$$frac{V_2}{V_1} = frac{T_2}{T_1}$$Substituindo os valores dados, temos:
$$frac{V_2}{20 l} = frac{400 K}{300 K}$$Multiplicando ambos os lados por 20 l, encontramos o volume ocupado pelo gás a 127°C:
$$V_2 = frac{400 K}{300 K} times 20 l = 26,7 l$$Portanto, a resposta certa é C) V = 26,7 l.
