Questões Sobre Termologia - Física - concurso
81) Considere 2 mols de um gás monoatômico ideal, inicialmente a 350K. O gás é aquecido reversivelmente até 500K enquanto seu volume é mantido constante. Determine a variação de entropia do gás. Dado: constante dos gases ideais: R cong 8,3J/mol cdot K.
- A) 8,3,Inleft( {large{7 over 10}} right)J/K
- B) 8,3,In left({large{10 over 7}} right)J/K
- C) 24,9,In left( {large{10 over 7}}right)J/K
- D) 24,9,In left({large{10 over 3}} right)J/K
- E) 24,9,In left({large{7 over 10}} right)J/K
To determine the entropy variation of the ideal gas,<|begin_of_text|>201C, we can use the following equation:ΔS = n * R * ln(T2 / T1)where ΔS is the entropy variation, n is the number of moles, R is the ideal gas constant, T1 is the initial temperature, and T2 is the final temperature.In this case, we have 2 moles of an ideal monoatomic gas, initially at 350 K. The gas is heated reversibly to 500 K, while its volume is kept constant.First, let's find the entropy variation:ΔS = 2 * 8,3 * ln(500 / 350)ΔS = 24,9 J/K
Therefore, the correct answer is alternative C) 24,9 J/K.
This result makes sense, since the entropy of the system increases as the temperature increases.
In an isothermal process, the entropy variation is directly proportional to the logarithm of the temperature ratio. In this case, the temperature ratio is approximately 1.43 (500 K / 350 K), which results in an entropy variation of approximately 24.9 J/K.
It's worth noting that, in a reversible process, the entropy variation of the system is equal to the entropy variation of the surroundings, but with opposite signs. In this case, the entropy of the surroundings decreases by 24.9 J/K, while the entropy of the system increases by the same amount.
82) Considere um gás confinado em um recipiente cilíndrico, de paredes fixas, exceto pela tampa, que é composta por um êmbolo móvel que exerce uma pressão constante (P) sobre o gás. Caso o gás se expanda e seu volume sofra um incremento Delta V, em função de deslocamento do êmbolo, o trabalho realizado pelo gás é
- A) P / Delta V.
- B) Delta V/P.
- C) P Delta V.
- D) -P Delta V.
A alternativa correta é letra C) P Delta V.
O trabalho é dado por:
W = p times Delta V
Como a questão pede o trabalho realizado pelo gás e ele está expandindo, o trabalho é positivo.
Gabarito: LETRA C.
Observação: a fórmula acima é uma dedução da fórmula (mais conhecida), obtida quando colocamos a componente Área na equação:
W = F times Delta d = dfrac{F}{A} times Delta dA = p times Delta V
83) O CO2 dissolvido em bebidas carbonatadas, como refrigerantes e cervejas, é o responsável pela formação da espuma nessas bebidas e pelo aumento da pressão interna das garrafas, tornando-a superior à pressão atmosférica. O volume de gás no “pescoço” de uma garrafa com uma bebida carbonatada a 7ºC é igual a 24 ml, e a pressão no interior da garrafa é de 2,8times105 Pa . Trate o gás do “pescoço” da garrafa como um gás perfeito. Considere que a constante universal dos gases é de aproximadamente 8 J/molcdotK e que as temperaturas nas escalas Kelvin e Celsius relacionam-se da forma T (K) = theta (ºC)+273. O número de moles de gás no “pescoço” da garrafa é igual a
- A) 1,2times105.
- B) 3,0times103.
- C) 1,2times10-1.
- D) 3,0times10-3.
A alternativa correta é letra D) 3,0times10-3.
Pessoal, precisamos aplicar diretamente a fórmula
PV = nRT
Vamos colocar os dados que temos
p = 2,8 times 10^5 , Pa
V = 24 , mL = 24 times 10^{-3} , L = 24 times 10^{-6} , m^3
R = 8 J/mol cdot K
T = 7 ^o C = 7 + 273 = 280 , K
A atenção aqui é com a transformação de unidades
2,8 times 10^5 times 24 times 10^{-6} = n times 8 times 280
n = 3,00 times 10^{-3} , mols
Esse valor equivale ao valor aproximado da alternativa D.
Gabarito: LETRA D.
Questão 84
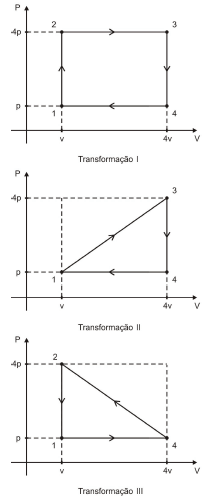
O gás realiza trabalhos totais τ_I, τ_{II} e τ_{III} respectivamente nas transformações I, II e III. Nessas condições, é correto afirmar que
- A) nas transformações I e II, há conversão de calor em trabalho pelo gás e τ_I > τ_{II}.
- B) na transformação III, há conversão de trabalho em calor pelo gás e τ_{III} > τ_I > τ_{II}.
- C) as quantidades de calor trocadas pelo gás com o meio externo nas transformações I, II e III são iguais.
- D) o trabalho total τ_I é positivo enquanto que τ_{III} e τ_{II} são negativos.
A alternativa correta é letra A) nas transformações I e II, há conversão de calor em trabalho pelo gás e τ_I > τ_{II}.
ALTERNATIVA CORRETA: LETRA A
Na transformação cíclica o estado final é igual ao estado inicial, implica que a variação da energia interna é nula (Delta U = 0).Sabendo que: Delta U = Q - tau
temos que: tau = QPortanto, no ciclo existe uma equivalência entre o calor trocado Q e o trabalho realizado W.Sinal do Trabalho
- Se a transformação for realizada no sentido horário, há uma conversão de calor em trabalho, ou seja, o trabalho é maior do que zero (tau>0).
- Se a transformação for realizada no sentido anti-horário existe uma conversão de trabalho em calor, ou seja, o trabalho é menor do que zero (tau<0).
Para os gráficos fornecidos temos que o trabalho pode ser obtido através da área do gráfico e seus sinais de acordo com o sentido do ciclo:
tau_I=tau=9PV=Q_I
tau_{II}=frac{tau}{2}=frac{9}{2}PV=Q_{II}
tau_{III}=-frac{tau}{2}=-frac{9}{2}PV=Q_{III}
Nos ciclos termodinâmicos temos, a máquina térmica e o refrigerador
a) nas transformações I e II, há conversão de calor em trabalho pelo gás e tau_I>tau{II}.
CORRETA
Há conversão de calor em trabalho pelo gás: Q_Q=Q_F+tau
tau_I>tau_{II}
tau>frac{tau}{2}
b) na transformação III, há conversão de trabalho em calor pelo gás e tau_{III}>tau_{I}>tau_{II}.
ERRADA
JUSTIFICATIVA: Há conversão de trabalho em calor pelo gás (Correto, pois se trata de um refrigerador)
tau_{III}<tau_{II}<tau_I.
c) as quantidades de calor trocadas pelo gás com o meio externo nas transformações I, II e III são iguais.
ERRADA
JUSTIFICATIVA:
Q_I=9PV
Q_{II}=frac{9}{2}PV
Q_{III}=-frac{9}{2}PV
d) o trabalho total tau_I é positivo enquanto que tau_{III} ~e~ tau_{II} são negativos.
ERRADA
JUSTIFICATIVA:
tau_I>0
tau_{II}>0
tau_{III}<0
ALTERNATIVA CORRETA: LETRA A
85) Certa massa de um gás ideal ocupava inicialmente o volume de 1,4 times 10^{-3}m^3, sob pressão de 8,0 times 10^4 Pa e temperatura de 280 K. Essa massa de gás sofreu uma transformação isobárica e sua temperatura aumentou para 360 K, de modo que seu volume também aumentou. O trabalho realizado pela força de pressão da massa de gás nessa transformação foi de
- A) 12 J
- B) 24 J
- C) 20 J
- D) 16 J
- E) 32 J
A alternativa correta é letra E) 32 J
Usaremos duas equações para solucionar a questão:
1°
frac{V_1}{T_1}=frac{V_2}{T_2}
frac{1,4 times 10^{-3}}{280}=frac{V_2}{360}
V_2=1,8 times 10^{-3}m^3
Com o volume final, é possível determinar o trabalho da transformação:
2°
Em uma transformação Isobárica o trabalho é dado, pelo produto entre a pressão (constante) e a variação do volume, assim:
W = ptimes Delta V = 8 times 10^4 times (1,8 times 10^{-3}-1,4 times 10^{-3})=32J
GABARITO LETRA E
86) A Lei de Stevin afirma que a diferença de pressão entre dois pontos em um líquido em repouso é igual ao produto da densidade do líquido d pela aceleração da gravidade g e pela altura da coluna do líquido h : p = p_0 + dgh. Já a Lei de Boyle-Mariotte afirma que a pressão de um gás p tende a diminuir à medida que o volume do recipiente V aumenta: p infty 1/V. Considere uma bexiga cheia de gás hélio tendo volume V_0 = 3000cm^3 a uma pressão atmosférica de p_0 = 100.000Pa. Ao se inseri1 · a bexiga a uma profundidade de 2 metros dentro de um açude, o volume da bexiga é:
- A) 1.200 cm3
- B) 1.500 cm3
- C) 2.500 cm3
- D) 3.000 cm3
- E) 3.600 cm3
A alternativa correta é letra C) 2.500 cm3
A questão forneceu as relações físicas necessárias.
Pessoal, a nova pressão será
p = 100.000 + 10^3 times 10 times 2 = 120.000 , Pa
Agora, temos que aplicar
P_0 V_0 = P V
100.000 times 3.000 = 120.000 times P
P = 2.500 , cm^3
Gabarito: LETRA C.
87)
- A) P_0 left( { large V_0 over V} right)^{ gamma}
- B) A P_0 left( { large V_0 over v} right)^{ gamma +1}
- C) A P_0 left( { large V_0 over v} right)
- D) A P_0 left( { large V_0 over v} right)^{ gamma}
- E) A,P_0
A alternativa correta é letra D) A P_0 left( { large V_0 over v} right)^{ gamma}
Gabarito: LETRA D.
Como as paredes são adiabáticas, não ocorre troca de calor durante a expansão do gás. Assim, de acordo com a lei geral dos gases ideais, podemos escrever a seguinte equação:
PV^{gamma} = mathrm{constante}
Então, sendo P a pressão quando o gás tiver expandido até o volume V, temos que
P_0 {V_0}^{gamma} = P V^{gamma}
Logo,
P = dfrac { P_0 {V_0}^{gamma} }{ V^{gamma} }
P = P_0 dfrac { {V_0}^{gamma} }{ V^{gamma} }
P = P_0 left( dfrac { V_0 } { V } right)^{gamma}
Sendo F a força resultante sobre o êmbolo de área A, a equação acima se torna
dfrac FA = P_0 left( dfrac { V_0 } { V } right)^{gamma}
F = A P_0 left( dfrac { V_0 } { V } right)^{gamma}
Portanto, a resposta correta é a alternativa (d).
88) O livre caminho médio lambda das moléculas é a distância média percorrida por uma molécula entre duas colisões, e é dado por
- A) 2,8 x 10-8
- B) 1,1 x 10-7
- C) 3,3 x 10-7
- D) 8,9 x 10-6
- E) 3,3 x 10-5
Para resolver essa questão, precisamos utilizar a fórmula do livre caminho médio (lambda) das moléculas, que é dada por:
lambda = frac{1}{sqrt{2} A frac{N}{V}}
Onde N/V é a concentração de moléculas e A é a seção de choque de uma molécula, ou sua área efetiva como alvo, que é função do seu diâmetro molecular.
Para calcular o valor do livre caminho médio (lambda) das moléculas de oxigênio, precisamos conhecer os valores de A, N e V.
Como o oxigênio é um gás ideal, podemos utilizar a equação de estado dos gases ideais para calcular a concentração de moléculas (N/V):
frac{N}{V} = frac{p}{kT}
Onde p é a pressão, k é a constante de Boltzmann e T é a temperatura em Kelvin.
Substituindo os valores dados na questão, temos:
frac{N}{V} = frac{100 times 10^3 Pa}{1,4 times 10^{-23} J/K times 300 K} = 2,38 times 10^{25} m^{-3}
Agora, precisamos calcular o valor de A. Como o diâmetro molecular do oxigênio é de aproximadamente 300 pm, podemos calcular a área efetiva como alvo como:
A = pi (frac{d}{2})^2 = pi (frac{300 times 10^{-12} m}{2})^2 = 7,07 times 10^{-19} m^2
Agora, podemos calcular o valor do livre caminho médio (lambda):
lambda = frac{1}{sqrt{2} A frac{N}{V}} = frac{1}{sqrt{2} times 7,07 times 10^{-19} m^2 times 2,38 times 10^{25} m^{-3}} = 1,13 times 10^{-7} m
Portanto, a resposta correta é a letra B) 1,1 x 10-7 m.
A explicação para essa resposta é que o livre caminho médio é uma medida da distância média percorrida por uma molécula entre duas colisões, e é influenciado pela concentração de moléculas e pela área efetiva como alvo das moléculas. No caso do oxigênio, o diâmetro molecular é relativamente pequeno, o que resulta em uma área efetiva como alvo também pequena, levando a um livre caminho médio maior.
89) Suponha que n mols de gás ideal vai de um estado inicial (V_1, T_1) para um estado final (V_1+Delta V, T_1+ Delta T) sob pressão P constante, onde as variáveis V e T representam, respectivamente, volume e temperatura absoluta. Vamos definir o coeficiente de dilatação “efetivo” do gás neste processo como sendo γ=Delta V/(V_1. Delta T). Com base nestas informações e sendo R a constante dos gases, podemos dizer que:
- A) γ={large{1 over T_1}}.
- B) γ={large{1 over T_2}}.
- C) γ={large{2 over T_2}}.
- D) γ={large{3 over T_1}}.
- E) γ={large{n over T_1}}.
A alternativa correta é letra A) γ={large{1 over T_1}}.
Gabarito: LETRA A.
De acordo com a lei dos gases ideais, podemos escrever:
PV = nRT
Onde P é a pressão, V é o volume, n é o número de mols, R é a constante dos gases ideais e T é a temperatura absoluta. Assim, para o estado inicial, temos:
PV_1 = nRT_1
Agora, vamos considerar o estado final, onde o volume é left( V_1 + Delta V right) e a temperatura é left( T_1 + Delta T right). Substituindo na equação dos gases ideais, lembrando que a pressão é constante, temos:
P left( V_1 + Delta V right) = nR left( T_1 + Delta T right)
Logo,
PV_1 + PDelta V = nRT_1 + nRDelta T
Porém, encontramos que PV_1 = nRT_1. Logo,
cancel {nRT_1} + PDelta V = cancel {nRT_1} + nRDelta T
PDelta V = nRDelta T
dfrac { Delta V } { Delta T } = dfrac { nR }{ P }
Entretanto, da relação PV_1 = nRT_1, temos que dfrac {nR}{P} = dfrac {V_1}{T_1}. Logo,
dfrac { Delta V } { Delta T } = dfrac {V_1}{T_1}
dfrac { Delta V } { V_1Delta T } = dfrac {1}{T_1}
Como γ=dfrac { Delta V } { V_1Delta T } , temos:
γ=dfrac 1{T_1}
Portanto, a resposta correta é a alternativa (a).
90) O texto a seguir é referência para a questão.
- A) V = V0
- B) V = frac {V_0} {4}
- C) V = 4V0
- D) V = 2V0
- E) V = frac {V_0} {2}
A alternativa correta é letra E) V = frac {V_0} {2}
Pessoal, precisamos conhecer a relação
dfrac{P_0V_0}{T_0} = dfrac{PV}{T}
Logo, substituindo pelas informações que o enunciado nos deu,
dfrac{P_0V_0}{T_0} = dfrac{4 P_0 V}{2T_0}
V_0 = 2 V
Como ele quer V em função de V0, devemos deixar V isolado.
V = dfrac{V_0}{2}
Gabarito: LETRA E.
