Para aquecer a quantidade de massa m de uma substância, foram consumidas 1450 calorias. A variação de seu calor específico c, em função da temperatura theta, está indicada no gráfico.
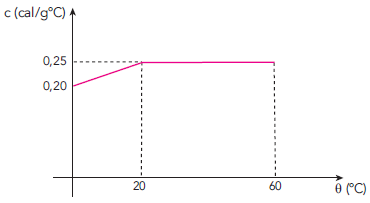
O valor de m, em gramas, equivale a:
- A) 50
- B) 100
- C) 150
- D) 300
Resposta:
A alternativa correta é letra B) 100
A relação entre a quantidade de calor (Q) e a variação de temperatura (Delta theta) sofrida por uma substância segue a relação:
Q=m cdot c cdot Delta theta
Porém, para a utilização dessa equação supõe-se um valor constante para o calor específico sensível (c), o que não ocorre para esta substância em toda a faixa de temperaturas apresentada.
Em física quando temos um gráfico, a área do gráfico abaixo da curva fornece a grandeza representada pelo produto dos eixos cartesianos, ou seja, para o gráfico dado no exercício de calor específico em função da temperatura, a área irá representar a grandeza (c cdot Delta theta).
Retornando à equação da quantidade de calor, podemos isolar a massa:
Q=m cdot c cdot Delta theta
m =dfrac{Q}{ color{brown}{c cdot Delta theta}} tag{I}
Onde o termo destacado pode ser encontrado através da área abaixo da curva do gráfico. Dividindo o gráfico em duas regiões (A_1 ;e ;A_2) vamos calcular a área de cada região.
A região A_1, possui o formato de um trapézio, sendo assim, a área do trapézio é dada por:
A_1= dfrac{(B+b)times h}{2}
A_1= dfrac{(0,25+0,2)times 20}{2} =dfrac{(0,25+0,2)timescancelto{10}{20}}{cancel{2}} = 0,45times 10
A_1=4,5
A região A_2 é um retângulo. Sua área é:
A_2 = b times h
A_2 = 40 times 0,25
A_2=10
Sendo assim:
(c cdot Delta theta) = A_1+A_2 =4,5+10
bbox[8px, border: 1px solid black]{color{black}{(c cdot Delta theta) = 14,5 , cal/g}}
Substituindo em (I), temos:
m =dfrac{Q}{ color{brown}{c cdot Delta theta}}
m =dfrac{Q}{ color{brown}{14,5}}
Como a quantidade de calor consumida durante esse aquecimento foi Q=1,450 ,cal , temos:
m=dfrac{1,450}{14,5}
bbox[8px, border: 2px solid #3498db]{color{#3498db}{m=100,g}}
Logo, o valor da massa da substância aquecida foi color{#3498db}{m=100,g}.

Deixe um comentário