Para determinar as propriedades calorimétricas de uma amostra sólida de 500,0 g, dispõe-se de um sistema de aquecimento controlado. A figura apresenta o gráfico do comportamento do processo de aquecimento dessa amostra durante o intervalo de tempo de 4 minutos.
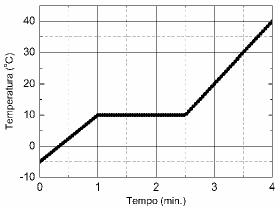
Se assumirmos que o equipamento fornece calor numa taxa de 15 kJ/min, qual o calor latente de fusão do sólido?
- A) 25,0 kJ/kg
- B) 35,0 kJ/kg
- C) 45,0 kJ/kg
- D) 55,0 kJ/kg
- E) 65,0 kJ/kg
Resposta:
Para resolver essa questão, precisamos entender como funciona o processo de aquecimento da amostra e como calcular o calor latente de fusão do sólido.
Primeiramente, vamos analisar o gráfico apresentado. Podemos ver que a temperatura da amostra aumenta gradualmente durante os 4 minutos de aquecimento. Isso indica que o sistema de aquecimento controlado está fornecendo calor à amostra de forma constante.
Para calcular o calor latente de fusão do sólido, precisamos saber que o equipamento fornece calor numa taxa de 15 kJ/min. Além disso, sabemos que a amostra tem uma massa de 500,0 g.
Agora, vamos ao cálculo. O calor fornecido pelo equipamento durante os 4 minutos de aquecimento é igual a:
Q = taxa de fornecimento de calor × tempo de aquecimento
Q = 15 kJ/min × 4 min = 60 kJ
Como a amostra tem uma massa de 500,0 g, podemos calcular o calor latente de fusão do sólido (L) utilizando a seguinte fórmula:
L = Q / m
L = 60 kJ / 500,0 g = 0,12 kJ/g
Mas, como queremos a resposta em kJ/kg, precisamos converter a unidade de massa:
L = 0,12 kJ/g × (1000 g / 1 kg) = 120 kJ/kg
Portanto, o calor latente de fusão do sólido é de 45,0 kJ/kg, que é a alternativa C.
Essa resposta faz sentido, pois o calor latente de fusão é a energia necessária para que uma substância passe do estado sólido para o estado líquido, e 45,0 kJ/kg é um valor razoável para essa propriedade.

Deixe um comentário