Para um gás ideal, considere os três processos termodinâmicos – 1, 2 e 3 – mostrados no diagrama P V. Cada processo tem o mesmo estado inicial e o mesmo volume final. Um processo é adiabático, um é isobárico e o outro isotérmico. Assinale a alternativa que identifica os processos: ADIABÁTICO, ISOBÁRICO e ISOTÉRMICO, respectivamente.
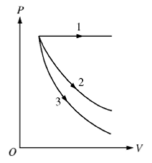
- A) 1, 2, 3.
- B) 2, 1, 3.
- C) 2, 3, 1.
- D) 3, 1, 2.
- E) 3, 2, 1.
Resposta:
A alternativa correta é letra D) 3, 1, 2.
Gabarito: LETRA D.
O processo isobárico consiste na transformação sob pressão constante, como nos mostra a figura a seguir:
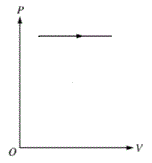
Então, podemos afirmar que o processo isobárico é identificado pela curva 1 do gráfico do enunciado.
Já um processo isotérmico é aquele em que a pressão e volume de um gás variam, porém sua temperatura é mantida constante. Para esse processo, o estado do gás é representado por uma curva sobre sua isoterma, como nos mostra a figura a seguir:
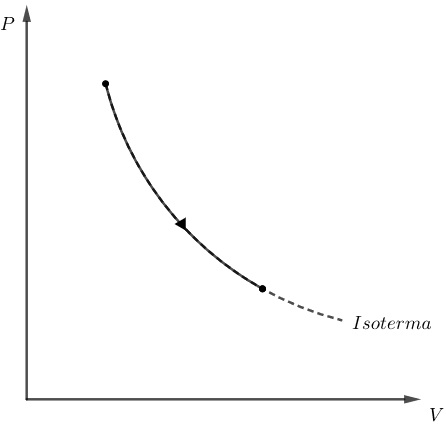
Por outro lado, um processo adiabático é uma transformação que ocorre sem troca de calor, ou seja, Q = 0. Assim, de acordo com a primeira lei da termodinâmica, temos
Delta U = Q - W
Delta U = 0 - W
Delta U = - W
Note que há uma variação negativa da energia interna do gás (diminuição da temperatura) que é equivalente (em módulo) ao trabalho realizado pelo gás. Ou seja, o estado do gás no diagrama PxV nesse processo é descrito por uma curva que liga uma isoterma a uma outra isoterma de temperatura mais baixa, como nos mostra a curva 3 na figura a seguir:
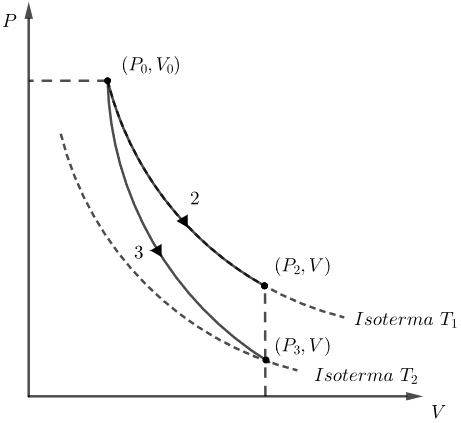
Então, podemos afirmar que o processo isotérmico é é descrito no gráfico pela curva 2 e o processo adiabático pela curva 3.
Portanto, o gabarito da questão é a alternativa (d).

Deixe um comentário