Quatro mols de ar a temperatura de 27 °C e pressão de 200 kPa está dentro de um pistão cilíndrico capaz de se mover na vertical. O pistão é aquecido mediante pressão constante até a temperatura de 227 °C, após atingir essa temperatura o sistema dissipa calor mediante um processo a volume constante e, retorna ao estado inicial mediante uma compressão adiabática. Tomando c_p = 0,2frac {kJ} {kg.K}. e c_v = 0,1frac {kJ} {kg.K} bar{M}_{ar} = 29 g/mol
- A) 1008 J
- B) 412 J
- C) 928 J
- D) 346 J
- E) 15 J
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
Gabarito: ANULADA.
Observando o enunciado, podemos perceber que a questão está incompleta, por isso a anulação da mesma. Porém, analisando as alternativas, podemos inferir que a banca queria que o candidato encontrasse um valor de energia.
Assim, para efeitos didáticos, vamos analisar os processos termodinâmicos que ocorrem sobre o sistema da questão.
De acordo com o enunciado, podemos considerar que o gás se encontra em um estado 1, é aquecido a pressão constante até um estado 2, dissipa calor mediante um processo a volume constante até um estado 3 e retorna ao estado inicial 1 mediante uma compressão adiabática, como nos mostra o diagrama PV abaixo:
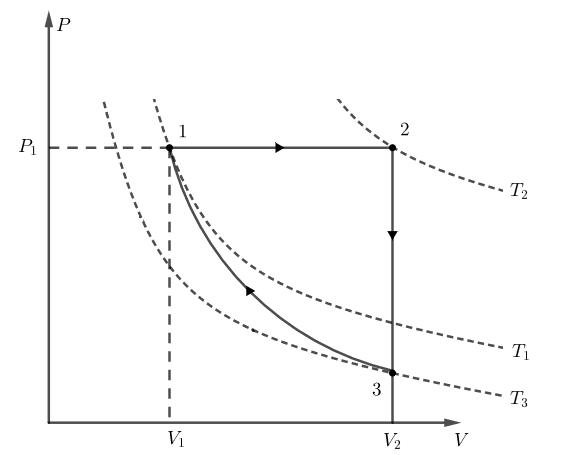
Aplicando a primeira lei da termodinâmica para o ciclo, podemos escrever:
Delta U_{ciclo} = Q_{ciclo} - W_{ciclo}
Como os estados final e inicial do ciclo são iguais, temos que Delta U_{ciclo} = 0. Logo,
0 = Q_{ciclo} - W_{ciclo}
W_{ciclo} = Q_{ciclo}
Ou seja, a soma do trabalho realizado pelo sistema é igual à soma do calor absorvido por ele.
A soma do calor absorvido pelo sistema é dado por:
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} + Q_{3 rightarrow 1}
Porém, como o processo 3 rightarrow 1 é adiabático, temos que Q_{3 rightarrow 1} = 0. Logo,
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} + 0
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3} tag 1
Como o processo 1 rightarrow 2 ocorre à pressão constante, e os valores de calor específico são dados em função da massa, o calor absorvido pelo sistema é dado por:
Q_{1 rightarrow 2} = n cdot overline {M_{ar}} cdot c_p cdot Delta T tag 2
Onde overline {M_{ar}} é a massa molar do gás, n é o número de mols do gás, c_p é o calor específico a pressão constante e Delta T é a variação de temperatura.
Do enunciado, temos que n = 4 , mols, overline{M_{ar}} = 29 , g/mol, c_p = 0,2dfrac {kJ} {kgcdot K}, T_1 = 27°C = 27 + 273 = 300 , K e T_2 = 227°C = 227 + 273 = 500 , K. Substituindo os valores na equação acima, temos:
Q_{1 rightarrow 2} = 4 cancel {mol} cdot 29dfrac { cancel g } { cancel {mol} } cdot 0,2dfrac { cancel k J}{ cancel k cancel g cdot cancel K} cdot left( 500 - 300 right) cancel K
Q_{1 rightarrow 2} = 4640, J
Como o processo 2 rightarrow 3 ocorre a volume constante, o calor dissipado pelo sistema é dado por:
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot Delta T
Onde c_v é o calo específico a volume constante. Logo,
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot left( T_3 - T_2 right) tag 3
Como não sabemos a temperatura T_3, vamos utilizar a relação entre a temperatura e o volume de uma transformação adiabática:
T_3 {V_3}^{gamma -1} = T_1 {V_1}^{gamma -1}
Onde gamma = dfrac { c_p } { c_v } = dfrac { 0,2 } { 0,1 } = 2. Logo,
T_3 {V_3}^{2 -1} = T_1 {V_1}^{2 -1}
T_3 {V_3} = T_1 {V_1}
T_3 = dfrac { V_1 } { V_3 } T_1
Porém, V_3 = V_2. Logo,
T_3 = dfrac { V_1 } { V_2 } T_1 tag 4
Entretanto, utilizando a Lei Geral dos Gases Ideais, podemos escrever:
dfrac { P_1 V_1 } { T_1 } = dfrac { P_2 V_2 } { T_2 }
Como P_1 = P_2
dfrac { cancel {P_1} V_1 } { T_1 } = dfrac { cancel {P_1} V_2 } { T_2 }
dfrac { V_1 } { T_1 } = dfrac { V_2 } { T_2 }
dfrac { V_1 } { V_2 } = dfrac { T_1 } { T_2 } tag 5
Substituindo (5) em (4), temos:
T_3 = dfrac { T_1 } { T_2 } T_1
T_3 = dfrac { {T_1}^2 } { T_2 }
Substituindo T_3 em (3), temos:
Q_{2 rightarrow 3} = n cdot overline{M_{ar} } cdot c_v cdot left( dfrac { {T_1}^2 } { T_2 } - T_2 right) tag 6
Substituindo os valores do enunciado, temos:
Q_{2 rightarrow 3} = 4 cdot 29 cdot 0,1 left( dfrac { 300^2 } { 500 } - 500 right)
Q_{2 rightarrow 3} = -3712 , J
O valor é negativo pois o sistema dissipa calor.
Então, substituindo Q_{2 rightarrow 3} e Q_{2 rightarrow 3} na equação (1), temos:
Q_{ciclo} = Q_{1 rightarrow 2} + Q_{2 rightarrow 3}
Q_{ciclo} = 4640 + left(-3712right)
Q_{ciclo} = 928 , J
Ou seja, a soma do calor recebido pela massa de ar no pistão é igual a 928 J.
Observando as alternativas, podemos verificar que há uma alternativa que corresponde ao valor que encontramos (letra c). Entretanto, a questão foi anulada.

Deixe um comentário