Três amostras de um gás ideal, com massas iguais e volumes V1, V2 e V3, têm suas temperaturas aumentadas conforme o gráfico a seguir.
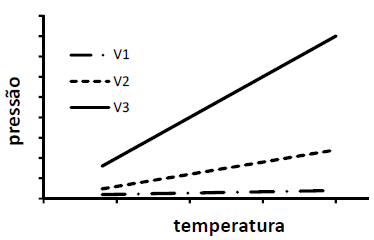
Assim, a relação entre os volumes é
- A) V1 = V2 > V3.
- B) V1 > V2 > V3.
- C) V1 = V2 < V3.
- D) V1 = V2 = V3.
Resposta:
A alternativa correta é letra B) V1 > V2 > V3.
Gabarito: LETRA B.
Para analisar a relação entre os volumes das três amostras de gás ideal, é importante entender como a pressão varia com a temperatura em um gás ideal.
De acordo com a lei geral dos gases ideais, essa relação é dada por:
dfrac { P cdot V } { T } = text{constante}
Onde P é a pressão, V é o volume T a temperatura do gás ideal. Manipulando a equação acima, podemos escrever:
dfrac { P cdot V } { T } = c
P = dfrac c V cdot T
Note que a equação acima estabelece uma relação linear entre a pressão e a temperatura de um gás ideal a um volume constante, ou seja, a equação que representa a pressão em função da temperatura é igual à equação y = mx de uma reta, como nos mostra a figura do enunciado.
Além disso, a razão m = dfrac c V representa o coeficiente angular da reta. Isso significa que quanto mais inclinada, maior o coeficiente angular da reta e, como o volume é inversamente proporcional a esse coeficiente, menor é o volume. Com isso, podemos afirmar que, quanto mais inclinada a reta PxT, menor é o volume do gás ideal.
Observando a figura do enunciado, podemos verificar que a inclinação da amostra 3 (linha cheia) é mais inclinada que a da amostra 2 (linha tracejada), que é mais inclinada que a da amostra 1 (traço e ponto). Então, a relação entre os volumes é a inversa, ou seja:
V_3 lt V_2 lt V_1
Ou, ainda,
V_1 gt V_2 gt V_3
Portanto, a resposta correta é a alternativa (b).

Deixe um comentário