Um calorímetro de capacidade térmica desprezível contém gelo a -20 oC. Nele é injetado vapor d`água a 100 oC. A figura abaixo representa, em gráfico cartesiano, como suas temperaturas variam em função das quantidades de calor (em módulo) que um cede e o outro recebe.
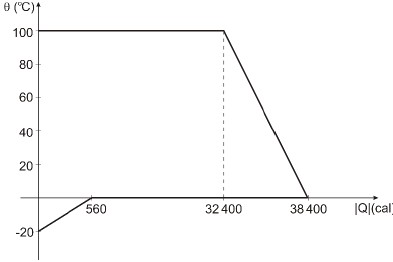
O calor específico a água (líquida) é 1,0 cal/goC e o calor latente de fusão do gelo é 80 cal/g. Ao ser atingido o equilíbrio térmico, a massa de água na fase líquida contida no calorímetro é
- A) 620 g.
- B) 560 g.
- C) 500 g.
- D) 470 g.
- E) 410 g.
Resposta:
ESTA QUESTÃO FOI ANULADA, NÃO POSSUI ALTERNATIVA CORRETA
O valor de água cede calor para o gelo, até que o sistema alcance o equilíbrio a mesma temperatura. Na fase inicial, o vapor de água se condensa até que toda a massa se torne água líquida. Durante este processo de condensação, que ocorre a temperatura constante de 100oC, a quantidade de calor latente cedida pelo vapor de água é:
Q=mL
Observação: O calor latente de condensação do vapor de água é de 540Cal/g. Essa informação não foi dada no enunciado.
Pelo gráfico do problema, notamos que os vapores de água cederam 32400 Calorias até se completar o processo de condensação. Logo,
32400=m_1times540
m_1=frac{32400}{540}
m_1=50g
Por outro lado, temos o gelo que receberá calor, elevando sua temperatura de -20oC a 0oC, depois teremos a fase do gelo a 0oC e por fim a fase em que todo o gelo se transforma em água a 0oC, prosseguindo na elevação de temperatura até que ocorra o equilíbrio térmico. Assim, percebe-se que são de três fases.
Aqui ocorre um outro problema dessa questão: não foi informado o calor específico do gelo, que é de 0,5Cal/g.
1. Pelo gráfico, o gelo está inicialmente a -20oC. Logo, usaremos a fórmula do calor do sensível para o gelo:
Q=mcdot ccdot Delta{theta}
560=m_2cdot 0,5cdot(0 - (-20))
m_2=frac{560}{10}=56g
2. Agora sabemos que são 56g de gelo a 0oC que receberão calor latente de fusão até que se transforme em água a 0oC:
Q=mL
Q=56times80
Q=4480 ,Cal
3. A partir dessa fase, temos 56g de água a 0oC e qualquer quantidade de calor recebida fará com que a massa de água eleve sua temperatura. Para obtermos 56g de água a 0oC a partir do gelo -20oC foram necessários 4480 Cal + 560 Cal = 5040 Cal.
Percebemos que tantos as massas de vapores de água e gelo envolvidas como as próprias informações do gráfico para equilíbrio térmico não são coerentes.
Portanto, a questão de fato mereceu anulação.
Gabarito: Anulada

Deixe um comentário