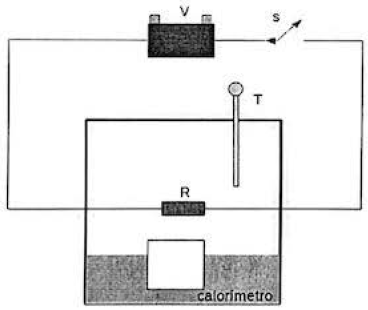
Um calorímetro está acoplado a um circuito elétrico composto por uma bateria que fornece uma tensão V = 10 V, uma chave S e um resistor de resistência R = 1,0 Omega capaz de fornecer energia térmica a seu interior. Um termômetro T também está no interior do calorímetro. confom1e figura abaixo. Utilizando esse equipamento, foi feito o seguinte procedimento experimental:
1. colocou-se 100 g de água a 10 ºC e 50 g de gelo com temperatura de – 10 ºC no calorímetro;
2. ligou-se a chave S por 220 s e desligou-se em seguida;
3. esperou-se que o termômetro T indicasse que o sistema (água+ gelo) alcançara o equilíbrio térmico e, então, foi feita a leitura da temperatura interna. Considerando-se que o termômetro e o calorímetro têm capacidade térmica desprezível e toda energia dissipada pelo resistor se converteu em calor, espera se que a temperatura indicada no termômetro T seja de:
(Dados: calor específico do gelo = 0,5 cal/g.ºC; calor específico da água = 1,0 cal/g. ºC; calor latente de fusão do gelo = 80 cal/g; 1 cal = 4 J)
- A) 15 ºC
- B) 20 ºC
- C) 25 ºC
- D) 30 ºC
- E) 35 ºC
Resposta:
A alternativa correta é letra A) 15 ºC
Gabarito: LETRA A.
Primeiramente, vamos calcular a potência dissipada pelo resistor:
P = dfrac { V^2 } { R }
P = dfrac { 10^2 } { 1,0 }
P = 100 , W
Assim, a energia dissipada pelo resistor é dada por
E = P cdot Delta t
E = 100 dfrac J { cancel s }cdot 220 { cancel s }
E = 22000 , J
E = 22000 cancel J cdot dfrac { 1 , cal } { 4 cancel J }
E = 5500 , cal
Toda energia dissipada pelo resistor se converteu em calor, composto por uma quantidade de calor Q_1 que foi responsável por aquecer o gelo, Q_2 para fundi-lo, Q_3 aquecer a massa de água correspondente à massa de gelo inicial até 10°C e Q_4 para aquecer a massa total de água de 10°C até a temperatura final, opu seja,
E = Q_1 + Q_2 + Q_3 + Q_4 tag 1
Como Q_1 é utilizado para aquecer a massa de gelo de -10°C até 0°C, temos
Q_1 = m_{gelo} cdot c_{gelo} cdot left( 0 - left( -10 right) right)
Q_1 = 50 cdot 0,5 cdot 10
Q_1 = 250 , cal
Como Q_2 é utilizado para fundir a massa de gelo, temos
Q_2 = m_{gelo} cdot L_{gelo}
Q_2 = 50 cdot 80
Q_2 = 4000 , cal
Como Q_3 é utilizado para aquecer a massa de água, que é igual à massa de gelo inicial, de 0°C até 10°C, temos
Q_3 = m_{gelo} cdot c_{água} cdot left( 10 - 0 right)
Q_3 = 50 cdot 1,0 cdot 10
Q_3 = 500 , cal
Como Q_4 é utilizado para aquecer a massa total de água de 10°C até a temperatura final theta_f, temos
Q_4 = m_{total} cdot c_{água} cdot left( theta_f - 10 right)
Q_4 = left( 100 + 50 right) cdot 1,0 cdot left( theta_f - 10 right)
Q_4 = 150 cdot left( theta_f - 10 right)
Substituindo em (1), temos que
E = Q_1 + Q_2 + Q_3 + Q_4
5500 = 250 + 4000 + 500 + 150 cdot left( theta_f - 10 right)
5500 = 4750 + 150 cdot left( theta_f - 10 right)
150 cdot left( theta_f - 10 right) = 750
theta_f - 10 = 5
theta_f = 15°C
Portanto, a resposta correta é a alternativa (a).

Deixe um comentário