Um cilindro de volume constante contém determinado gás ideal à temperatura T_0 e pressão p_0. Mantém-se constante a temperatura do cilindro e introduz-se, lentamente, a partir do instante t=0, certa massa do mesmo gás.
O gráfico abaixo representa a massa m de gás existente no interior do cilindro em função do tempo t.
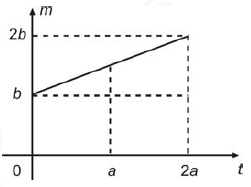
Nessas condições, a pressão do gás existente no recipiente, para o instante t=a, é igual a
- A) 1,5 , p_0
- B) 2,0 , p_0
- C) 2,5 , p_0
- D) 4,0 , p_0
Resposta:
A resposta correta é a letra A) 1,5 p₀.
Vamos analisar o problema: temos um cilindro de volume constante que contém um gás ideal à temperatura T₀ e pressão p₀. Em seguida, introduzimos lentamente uma massa adicional do mesmo gás, mantendo a temperatura do cilindro constante.
O gráfico apresentado mostra a massa m de gás existente no interior do cilindro em função do tempo t.
Como a temperatura é constante, a equação de estado dos gases ideais é válida:
$pV = nRT$
Como o volume é constante, a pressão p é diretamente proporcional ao número de mols n. Além disso, como a temperatura é constante, a pressão p também é diretamente proporcional à massa m do gás.
Portanto, à medida que a massa do gás aumenta, a pressão também aumenta. No instante t = a, a pressão do gás é igual a 1,5 p₀.
A alternativa A) é a única que apresenta essa relação correta entre a pressão e a massa do gás.

Deixe um comentário