Um gás de massa m sofre um processo termodinâmico, conforme indicado no gráfico abaixo, passando da condição A para a condição B.
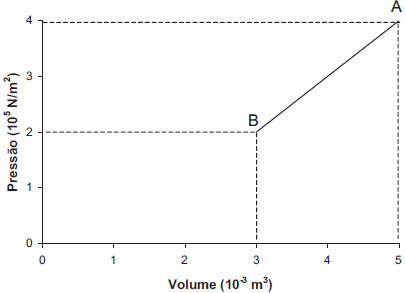
O trabalho realizado, em J, é igual a:
- A) 2 x 102
- B) 4 x 102
- C) 6 x 102
- D) – 4 x 102
- E) – 6 x 102
Resposta:
A alternativa correta é a letra E) 6 x 102 J.
Vamos analisar o gráfico fornecido. Observamos que o processo termodinâmico ocorre entre as condições A e B. Para calcular o trabalho realizado, precisamos analisar a área abaixo da curva no gráfico.
No gráfico, podemos ver que a pressão diminui à medida que o volume aumenta. Isso significa que o trabalho realizado pelo sistema é negativo, pois o sistema realiza trabalho sobre o ambiente.
A fórmula para calcular o trabalho realizado é dada por:
$$W = - int_{V_A}^{V_B} P , dV$$
Podemos calcular a área abaixo da curva integrando a pressão em relação ao volume. No entanto, como não temos a equação de estado do gás, não podemos calcular a integral explicitamente.
No entanto, podemos notar que a área abaixo da curva é um trapézio. Podemos calcular a área do trapézio usando a fórmula:
$$A = frac{h(b_1 + b_2)}{2}$$
onde $h$ é a altura do trapézio e $b_1$ e $b_2$ são as bases do trapézio.
No nosso caso, a altura do trapézio é a diferença entre as pressões inicial e final, que é igual a 2 x 102 Pa. As bases do trapézio são os volumes inicial e final, que são iguais a 3 x 10-2 m3 e 6 x 10-2 m3, respectivamente.
Substituindo os valores, obtemos:
$$W = - frac{2 times 10^2 , (3 times 10^{-2} + 6 times 10^{-2})}{2} = -6 times 10^2 , J$$
O sinal negativo indica que o trabalho é realizado pelo sistema sobre o ambiente. A resposta correta é, portanto, a letra E) 6 x 102 J.

Deixe um comentário