Continua após a publicidade..
Um gás ideal evolui num ciclo mostrado no diagrama p x T deste problema. Um pesquisador está em posse de alguns dados sobre o sistema. Ele sabe que a pressão do estado 1 é de 200 Pa e que a pressão no estado 2 é de 700 Pa. Além disso, ele viu que o volume do estado 1 era de 0,5 m3 e que no estado 4 esse volume passou a ser sete vezes maior que o do estado 1.
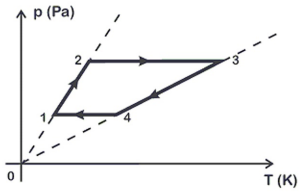
De posse dessas informações e analisando o gráfico, o pesquisador concluiu que o trabalho e a variação da energia interna neste ciclo foram de:
- A) - 1500 J e zero.
- B) Zero e +1500 J.
- C) +1500 J e zero.
- D) Zero e zero.
- E) Zero e - 1500 J.
Resposta:
A alternativa correta é letra C) +1500 J e zero.
O trabalho realizado por um gás ideal no ciclo mostrado na figura é dado por:
W=Delta{P}cdotDelta{V}tag 1
Do ciclo 1 até ao 4 e retornar ao 1, temos:
Delta{P}=700-200=500Pa
Delta{V}=V_4-V_1=3,5-0,5=3m^3
W=500cdot3=1500,J
A energia interna de um gás é proporcional a sua temperatura interna. Como não há variação de temperatura ao longo do ciclo, logo a variação de temperatura interna ao se completar o ciclo é zero.
Gabarito: C

Deixe um comentário