Um gás ideal passa pelas transformações I, II, III e IV, voltando ao estado inicial de volume 0,01 m^3 e temperatura de 200 K, como representado no diagrama volume X temperatura a seguir.
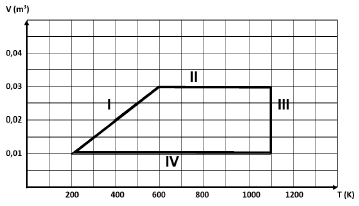
De acordo com o diagrama, é correto afirmar que durante o processo
- A) I o gás passa por uma transformação adiabática.
- B) II é realizado trabalho sobre o gás.
- C) III o gás perde calor para a vizinhança.
- D) IV a energia interna do gás aumenta.
Resposta:
A alternativa correta é letra C) III o gás perde calor para a vizinhança.
A questão trata de uma transformação cíclica representada em um diagrama VxT. Assim, vamos analisar cada uma das alternativas:
a) I o gás passa por uma transformação adiabática. INCORRETA.
Em uma transformação adiabática, não há troca de calor com o meio externo. De acordo com o diagrama, temos:
dfrac {P_1V_1}{T_1} = dfrac {P_2V_2}{T_2}
dfrac {P_1 cdot 0,01}{200} = dfrac {P_2 cdot 0,03}{600}
P_1 = P_2
Na verdade, temos uma transformação isobárica, ou seja, a pressão é mantida constante. Alternativa incorreta.
b) II é realizado trabalho sobre o gás. INCORRETA.
No processo II, não há variação de volume. Logo, não há realização de trabalho. Alternativa incorreta.
c) III o gás perde calor para a vizinhança. CORRETA.
No processo III, temos uma compressão do gás a uma temperatura constante. Da primeira lei da termodinâmica, temos:
Delta U = Q - W
Como a temperatura é constante, temos que Delta U = 0. Logo,
Q = W
Como o gás é comprimido, o trabalho é negativo. Assim, o calor também é negativo. Isso significa que o gás perde calor para a vizinhança. Alternativa correta.
d) IV a energia interna do gás aumenta. INCORRETA.
No processo IV, a temperatura do gás diminui. Como a energia interna está associada à temperatura do gás, a energia interna durante o processo IV também diminui. Alternativa incorreta.
Portanto, a resposta correta é a alternativa (C).

Deixe um comentário