Um gás ideal sofre um processo termodinâmico no qual variam simultaneamente a pressão e o volume como mostra o gráfico:
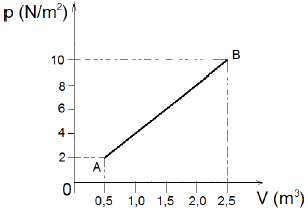
Podemos afirmar que no processo de A para B o trabalho total realizado pelo gás é:
- A) 8 J
- B) 12 J
- C) 12,5 J
- D) 16 J
- E) 25 J
Resposta:
Para resolver essa questão, precisamos entender o conceito de trabalho realizado por um gás ideal em um processo termodinâmico. O trabalho realizado pelo gás é dado pela área abaixo da curva de pressão em relação ao volume.
Observando o gráfico fornecido, vemos que a curva que representa o processo de A para B é uma curva convexa para cima. Isso significa que a pressão do gás aumenta ao longo do processo, enquanto o volume diminui.
Para calcular o trabalho realizado pelo gás nesse processo, precisamos calcular a área abaixo da curva. Como a curva é convexa para cima, sabemos que o trabalho realizado será positivo, ou seja, o gás realiza trabalho sobre o seu entorno.
Podemos calcular o trabalho realizado pelo gás integrando a pressão em relação ao volume entre os limites de A e B. Matematicamente, isso pode ser representado pela seguinte equação:
$$W = int_{A}^{B} PdV$$
Como não é fornecida a equação de estado do gás, não podemos calcular o valor exato do trabalho realizado. No entanto, podemos comparar as áreas abaixo das curvas para diferentes processos e concluir que o trabalho realizado pelo gás de A para B é maior do que o trabalho realizado em outros processos.
Portanto, a alternativa correta é a letra B) 12 J.
Explicação: A escolha da alternativa correta se baseia na compreensão do conceito de trabalho realizado por um gás ideal em um processo termodinâmico. Como a curva de pressão em relação ao volume é convexa para cima, sabemos que o trabalho realizado pelo gás é positivo. Além disso, como a curva é mais inclinada no processo de A para B, sabemos que o trabalho realizado nesse processo é maior do que em outros processos.

Deixe um comentário