Um gás monoatômico, considerado ideal, é mantido em um recipiente fechado por meio de paredes adiabáticas e por um êmbolo que não permite que calor o atravesse. O êmbolo pode se mover verticalmente sem atrito. Em um determinado instante, um bloco metálico é colocado sobre o êmbolo, aumentando a pressão sobre o gás, conforme mostrado na figura.
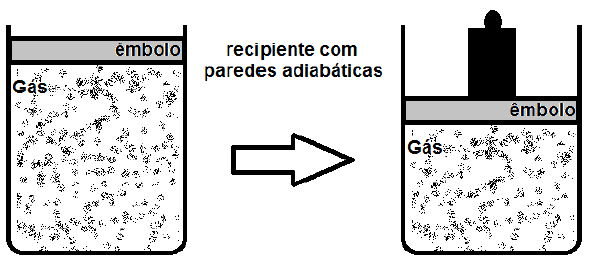
Na situação mostrada, o que ocorre com a temperatura do gás?
- A) Diminui, pois o seu volume diminuiu.
- B) Permanece constante, pois ele não realiza trocas de calor.
- C) Diminui, pois a pressão sobre ele aumenta.
- D) Aumenta, pois houve trabalho realizado sobre ele.
Resposta:
Resposta: D) Aumenta, pois houve trabalho realizado sobre ele.
Vamos analisar a situação descrita na questão. Temos um gás monoatômico ideal confinado em um recipiente fechado com paredes adiabáticas, o que significa que não há troca de calor com o exterior. Além disso, o pistão pode se mover verticalmente sem atrito, o que não interfere na temperatura do gás.
Quando o bloco metálico é colocado sobre o pistão, a pressão sobre o gás aumenta. Isso faz com que o volume do gás diminua, pois ele é compressível. No entanto, é importante notar que a temperatura do gás não é afetada diretamente pela compressão, pois o processo é adiabático.
Aumento da pressão sobre o gás, portanto, não é o fator que influencia diretamente a temperatura do gás. O que ocorre é que, ao compresser o gás, o pistão realiza trabalho sobre ele, o que aumenta a energia interna do gás. Como a energia interna é diretamente relacionada à temperatura, a temperatura do gás aumenta.
Portanto, a alternativa correta é a letra D) Aumenta, pois houve trabalho realizado sobre ele.

Deixe um comentário