Um gás monoatômico ideal é confinado em um tubo com embolo controlável. Suas transformações são esquematizadas pelo diagrama p-V abaixo.
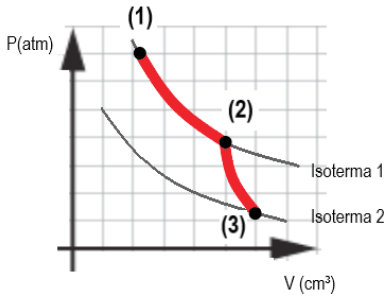
O gás vai do estado (1) para o estado (2) através de uma expansão isotérmica. Posteriormente, sai do estado (2) e vai para o estado (3) através de uma expansão adiabática. Quanto aos processos citados é correto dizer que:
- A) não há variação da energia interna em nenhum dos processos, porém o trabalho é positivo em ambos os processos.
- B) Não há troca de calor com o ambiente na expansão isotérmica, e não há variação da energia interna na expansão adiabática.
- C) A temperatura reduz na expansão adiabática, indicando perda de calor para o meio.
- D) Não há variação da energia interna do gás na expansão isotérmica, e há uma redução da energia interna na expansão adiabática.
Resposta:
A resposta correta é a letra D) NÃO há variação da energia interna do gás na expansão isotérmica, e HÁ uma redução da energia interna na expansão adiabática.
Vamos entender melhor o que acontece em cada processo:
Na expansão isotérmica, o gás recebe calor do ambiente e o utiliza para realizar trabalho. Nesse processo, a temperatura do gás permanece constante, pois a energia recebida do ambiente é igual à energia gasta em realizar trabalho. Portanto, a energia interna do gás não varia.
Já na expansão adiabática, o gás não recebe nem cede calor ao ambiente. Nesse caso, a energia interna do gás é utilizada para realizar trabalho, o que significa que a energia interna do gás diminui. Além disso, como o gás se expande, a temperatura também diminui.
Portanto, a alternativa D) é a correta, pois a energia interna do gás não varia na expansão isotérmica, e há uma redução da energia interna na expansão adiabática.

Deixe um comentário