Um mole de um gás monoatômico ideal, inicialmente a uma temperatura T, se expande de um volume V até um volume 2V em duas situações:
(i) a temperatura constante;
(ii) a pressão constante.
Com relação ao trabalho realizado na expansão e ao calor absorvido pelo gás, em cada situação, é CORRETO afirmar que:
- A) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
- B) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é maior que o calor absorvido na situação (ii).
- C) O trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é maior que o calor absorvido na situação (ii).
- D) O trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
- E) Nas duas situações, tanto o trabalho realizado quanto o calor absorvido são nulos.
Resposta:
A alternativa correta é letra A) O trabalho realizado na situação (i) é maior que o trabalho realizado na situação (ii); o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
Podemos representar as transformações do gás através do diagrama PxV a seguir:
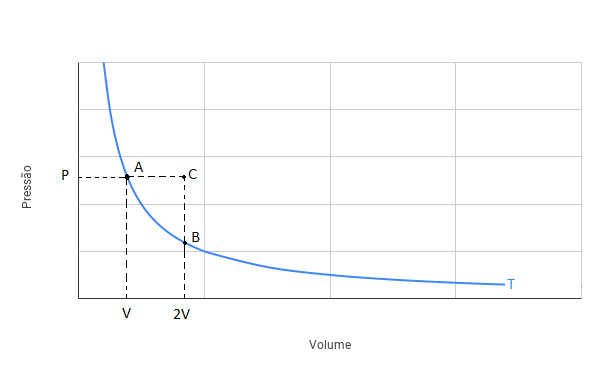
No gráfico acima, a curva em azul é uma isoterma. Assim, a transformação do gás na situação (i) vai do ponto A até o ponto B, percorrendo a curva isoterma. Na situação (ii), o gás vai do ponto A até o ponto C percorrendo uma linha horizontal (pressão constante).
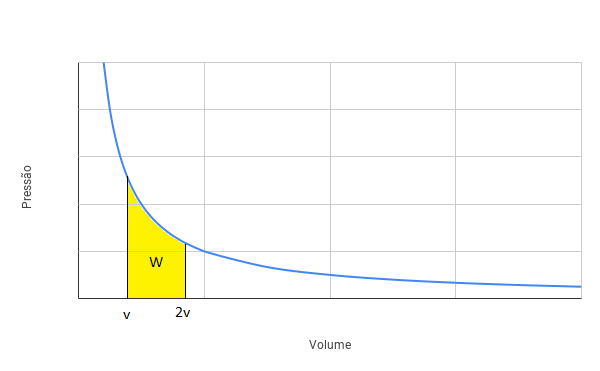
Do gráfico, a área sob a curva da transformação é numericamente igual ao trabalho realizado pelo gás. Na situação (i), temos uma transformação isotérmica. Logo, podemos ilustrar o trabalho realizado no diagrama PxV mostrado na figura a seguir:
Para a situação (ii), podemos representar a transformação na figura a seguir:
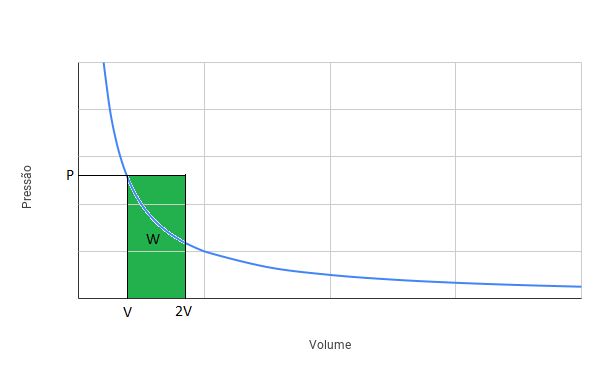
Podemos verificar que a área verde (trabalho da transformação isobárica) é maior do que a área amarela (trabalho da transformação isotérmica). Logo, o trabalho realizado na situação (i) é MENOR que o trabalho realizado na situação (ii).
De acordo com a primeira lei da termodinâmica, podemos calcular a quantidade de calor trocada através da equação:
Q = Delta U + W
Em uma transformação isotérmica, como a situação (i), a variação da energia interna é nula. Assim, temos:
Q = W
Podemos calcular o trabalho realizado em uma transformação isotérmica da seguinte forma:
W_{i} = W_{A rightarrow B} = displaystyle int_{A}^{B} p dV = displaystyle int_{A}^{B} dfrac{nRT}{V} dV =nRT displaystyle int_{A}^{B} dfrac{1}{V} dV = nRT ln dfrac{V_B}{V_A}
Logo,
W_{i} = nRT ln dfrac{2V}{V}
W_{i} = nRT ln 2
Assim, o calor transferido na situação (i) é Q_i = ln 2 cdot nRT
Na situação (ii), a pressão é constante e o trabalho pode ser calculado como:
W_{ii} = W_{A rightarrow C} = displaystyle int_{A}^{C} P dV = P displaystyle int_{A}^{C} dV = P (V_C - V_A)
W_{ii} = P( 2V - V) = PV
Ou então:
W_{ii} = nRT
A variação da energia interna de um gás monoatômico ideal é dado por:
Delta U = dfrac{3}{2} nR Delta T
Logo, o calor transferido na situação (ii) pode ser calculado da seguinte forma:
Q_{ii} = Delta U_{ii} + W_{ii}
Q_{ii} = dfrac{3}{2} nR (T_C - T) + nRT
Ainda, temos que:
dfrac{P_A V_A}{T_A} = dfrac{P_C V_C}{T_C}
dfrac{cancel P cancel V}{T} = dfrac{cancel P 2cancel V}{T_C}
T_C = 2 T
Logo
Q_{ii} = dfrac{3}{2} nR (2T - T) + nRT
Q_{ii} = dfrac{3}{2} nRT + nRT
Q_{ii} = dfrac{5}{2} nRT
Sabemos que ln 2 approx 0,69 e dfrac {5}{2} = 2,5. Então, podemos escrever,
ln 2 < dfrac{5}{2}
Como ln 2 < 1, podemos escrever:
ln 2 cdot nRT < dfrac{5}{2} cdot nRT
Q_i < Q_{ii}
Apesar da banca indicar a alternativa (A) como gabarito da questão, a resposta correta seria a alternativa (D), pois o trabalho realizado na situação (i) é menor que o trabalho realizado na situação (ii) e o calor absorvido na situação (i) é menor que o calor absorvido na situação (ii).
O gabarito oficial da banca indicou a resposta (A) como correta,

Deixe um comentário