Continua após a publicidade..
Uma amostra de n mols de gás ideal sofre as transformações AB (isovolumétrica), BC (isobárica) e CD (isotérmica) conforme representação no diagrama pressão (p) x volume (V), mostrado a seguir.
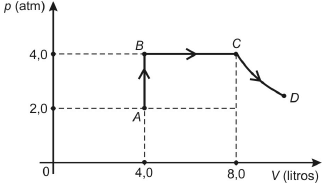
Sabendo-se que a temperatura do gás no estado A é 27 °C , pode-se afirmar que a temperatura dele, em °C, no estado D é
- A) 108
- B) 327
- C) 628
- D) 927
Resposta:
A alternativa correta é letra D) 927
Pessoal, vamos aplicar
(dfrac{PV}{T})_A = (dfrac{PV}{T})_C
dfrac{2 times 4}{300} = dfrac{4 times 8}{T_C}
Reparem que sequer precisamos analisar as transformações.
T_C = 1.200 , K
Se a questão fosse maldosa, poderia colocar essa entre as alternativas em graus Celsius.
T_C = 1.200 - 273 = 927°C
Gabarito: LETRA D.

Deixe um comentário