Uma seringa, na posição vertical, tampada, contém 200 cm 3 de ar em equilíbrio térmico com a vizinhança e pressão inicial de 1,0 x 10 5 Pa. A área da seção transversal da seringa é de 15,0 cm 2, e seu êmbolo pode movimentar- se livremente. Uma massa de 3,00 kg é pendurada no êmbolo de forma que ele atinge a posição final de equilíbrio com temperatura igual à inicial, como mostra a Figura a seguir.
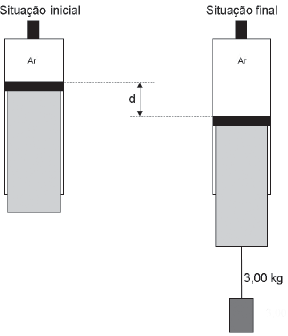
Considerando-se o ar um gás ideal que não vaza da seringa, a distância d entre as posições inicial e final do êmbolo da seringa, em cm, vale, aproximadamente:
- A) 1,00
- B) 3,33
- C) 4,44
- D) 5,33
- E) 16,7
Resposta:
A alternativa correta é letra B) 3,33
Vamos analisar a situação final da questão proposta. Quando a massa é pendurada, o ar dentro da seringa torna-se rarefeito, pois a mesma quantidade de ar ocupará uma área maior. O ar ficará “mais solto”, exercendo portanto uma pressão menor. Essa diferença de pressão é causada pela força peso da massa pendurada, assim podemos calcular da seguinte forma:
Delta P=dfrac{F}{A}=dfrac{m cdot g}{A_{seção}}=dfrac{3 cdot 10}{15 cm^2}=dfrac{30}{15 cdot 10^{-4} m^2}= 0,2 cdot 10^5 dfrac{N}{m^2}
Logo, a pressão na situação final é calculada como:
P_2 = P_1 - Delta P = 1,0 cdot 10^5 - 0,2 cdot 10^5
P_2 = 0,8 cdot 10^5 dfrac{N}{m^2}
Para encontrar o volume na situação final, podemos utilizar a equação geral de transformação dos gases ideais:
dfrac{P_1 cdot V_1}{T_1} = dfrac{P_2 cdot V_2}{T_2}
Como T_1 = T_2, temos:
V_2 = dfrac{P_1 cdot V_1}{P_2}
Na situação inicial, temos as seguintes condições:
V_1 = 200 cm^3 = 2,0 cdot 10^{-4} m^3
P_1 = 1,0 cdot 10^5 Pa
Logo,
V_2 = dfrac{P_1 cdot V_1}{P_2} = dfrac{1,0 cdot 10^5 times 2,0 cdot 10^{-4}}{0,8 cdot 10^5}
V_2 = 2,5 cdot 10^{-4} m^3
Assim, podemos calcular o deslocamento do êmbolo da seguinte maneira:
V_2 - V_1 = d cdot A_{seção}
d = dfrac {V_2 - V_1}{A_{seção}}
d = dfrac {2,5 cdot 10^{-4} - 2,0 cdot 10^{-4} m^3}{15 cdot 10^{-4} m^2}
d = 0,033 m
d = 3,3 cm
Portanto, a alternativa correta é a b.

Deixe um comentário