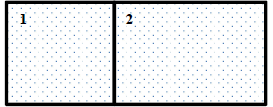
(URCA/2020.1) Um cilindro fechado que contém hidrogênio se divide em dois compartimentos desiguais por meio de um pistão móvel que no equilíbrio toma a posição mostrada na figura. A temperatura é a mesma nos dois compartimentos. Das seguintes afirmações a correta é:
- A) Os dois compartimentos contêm igual número de mols;
- B) A energia cinética média por molécula é maior no compartimento 2 que no 1;
- C) A massa de uma molécula do compartimento 2 é o dobro da massa de uma molécula do compartimento 1;
- D) As pressões nos dois compartimentos são iguais;
- E) O número de átomos nos compartimentos é igual.
Resposta:
A alternativa correta é letra D) As pressões nos dois compartimentos são iguais;
Questão de teoria cinética dos gases. Vamos obter as informações do enunciado para posteriormente julgarmos as alternativas:
(I) - “Um cilindro fechado que contém hidrogênio...”
O mesmo gás está presente em ambos os compartimentos.
(II) - “...se divide em dois compartimentos desiguais...”
O volume do compartimento 1 é diferente do compartimento 2 e através da figura podemos ver que V_2gt V_1.
(III) - “...por meio de um pistão móvel que no equilíbrio toma a posição mostrada na figura....”
Como o pistão é móvel, se houver uma força resultante em algum dos lados, o pistão se movimentará até ele atingir o equilíbrio. Como dito acima, a figura representa a posição de equilíbrio, portanto
F_1=F_2
Como a área da parede móvel é a mesma para os dois compartimentos (A), dividindo ambos os lados da igualdade anterior pela área, temos:
dfrac{F_1}{A}=dfrac{F_2}{A} ;; implies ;; P_1=P_2
(IV) - “A temperatura é a mesma nos dois compartimentos.”
T_1=T_2
Agora analisando as alternativas:
a) Os dois compartimentos contêm igual número de mols;
Errada. Comentada na alternativa e.
b) A energia cinética média por molécula é maior no compartimento 2 que no 1;
Errada. A energia cinética média de um gás ideal segue a expressão:
E_c=dfrac{3}{2}nRT
Para encontrarmos a energia cinética média por molécula, devemos dividir pelo número de moléculas (N). Sendo N_A o número de Avogadro, temos:
N=n cdot N_A
Dividindo E_c por N temos:
dfrac{E_c}{N}=dfrac{3}{2 n cdot N_A }nRT=dfrac{3}{2 cancel{n} cdot N_A }cancel{n}RT=dfrac{3}{2 cdot N_A }RT=dfrac{3}{2}kT
Onde
k=dfrac{R}{N_A} qquad text {é chamada de constante de Boltzmann}
Da equação anterior, vemos que a energia cinética média por molécula de um gás ideal, depende apenas da temperatura pois todo o restante são constantes. Como T_1=T_2 , as energias também são iguais.
c) A massa de uma molécula do compartimento 2 é o dobro da massa de uma molécula do compartimento 1;
Errada. Como o gás contido nos dois compartimentos é o mesmo, as moléculas possuem mesma massa.
d) As pressões nos dois compartimentos são iguais;
Correta. Como descrito no item (III)
e) O número de átomos nos compartimentos é igual.
Errada. Assumindo que se trata de um gás ideal, com P_1=P_2; mbox{,}; T_1=T_2 ;mbox{e}; V1lt V_2 temos:
PV=nRT ;; implies ;; n=dfrac{PV}{RT}
n_1=dfrac{P_1V_1}{RT_1}
n_2=dfrac{P_2V_2}{RT_2}
Adotando
dfrac{P_1}{RT_1}=dfrac{P_2}{RT_2}=C
n_1=CV_1
n_2=CV_2
Portanto o numero de mols (consequentemente o número de átomos) é proporcional ao volume, como V_2 lt V_1, o número de átomos do compartimento 2 é maior que o número de átomos do compartimento 1.

Deixe um comentário