Continua após a publicidade..
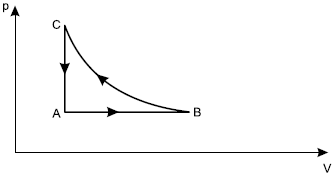
A respeito dessas transformações, afirmou-se o seguinte:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação![straight A rightwards arrow straight B]() , o gás recebe calor e realiza trabalho.
, o gás recebe calor e realiza trabalho.
Está correto apenas o que se afirma em:
I. O trabalho total realizado no ciclo ABCA é nulo.
II. A energia interna do gás no estado C é maior que no estado A.
III. Durante a transformação
Está correto apenas o que se afirma em:
Note e adote:
O gás deve ser tratado como ideal; a transformação![begin mathsize 11px style straight B rightwards arrow straight C end style]() é isotérmica.
é isotérmica.
O gás deve ser tratado como ideal; a transformação
- A) I
- B) II
- C) III
- D) I e II
- E) II e III
Resposta:
A alternativa correta é letra E
Vamos analisar cada uma das afirmativas. A primeira afirmativa nos diz que o trabalho total deste ciclo é nulo, para isso vamos analisar cada uma das três partes deste ciclo, para desco b rir o trabalho em cada momento. De A para B temos um processo isobárico, ou seja, a pressão é constante. Com isso, temos que o trabalho é dado pela fórmula:
W = −pV
dado que W é o trabalho, p é a pressão e
V = Vf − Vi
isto é, a variação no volume. Sabemos que W>0 quer dizer que o sistema recebeu trabalho, e W<0 que o sistema realizou trabalho. No processo em questão como o volume final é maior q ue o inicial, então:
W = −p1(V2 − V1).
No processo B para C temos um processo isotérmico, como informado. Assim sendo,
W = nRTln(V2/V1)
Dado que n é o número de mols do gás, R é a constante universal dos gases perfeitos e T é a temperatura. E por fim temos o processo de C para A, onde por ser isocórico o trabalho é nulo, visto que não tem variação no volume. E assim temos:
Wtot = WA→B + WB→C + WC→A
Wtot = −p1(V2 − V1) + nRTln(V2/V1) + 0
Wtot = −p1(V2 − V1) + nRTln(V2/V1) + 0
Além do mais, devemos lembrar que o trabalho total do ciclo é a área da figura, e assim fica evidente que seu valor é diferente de zero, pois a área é diferente de zero. Dessa forma, chegamos que a afirmativa I é falsa. A afirmativa II diz respeito à energia interna deste gás em dois momentos distintos. Como não sabemos se o gás é monoatômico ou poliatômico vamos usar a seguinte expressão:
Eint = kpV
dado que k é uma variável que depende do grau de liberdade L das partículas (k = L/2), p é a pressão e V é o volume. Com isso, temos:
Eint C = kp2V1
E,
Eint A = kp1V1
Como p2>p1 então Eint C>Eint A e a afirmação II é verdadeira. Por fim, a última afirmação diz respeito à transformação A para B. Como já calculamos o trabalho nesta parte, podemos observar que seu valor é negativo, o que implica que o sistema está realizando trabalho. E assim, usamos a primeira lei da termodinâmica:
dU = Q + W
em que Q é positivo se o sistema recebe calor, e W é positivo se é realizado trabalho no sistema. Usando a expressão de U mostrada acima, temos:
Uf − Ui = kp1V2 − kp1V1 = Q + W
Q = kp1V2 − kp1V1 − W
Q = kp1V2 − kp1V1 − W
Com isso, já que:
V2 > V1
Então:
kp1V2 > kp1V1
E já que:
−W > 0
Então:
Q > 0
E assim temos que o sistema recebe calor. Estão coerentes as assertivas II e III, portanto, a resposta correta é a alternativa E.

Deixe um comentário